Топливный блок SteelHeat S-LINE 1200 в . Отзывы и фото.
 Горит не само топливо, а его пары. Размер отверстий решетки подобран таким образом, чтобы обеспечить оптимальный уровень огня, при экономичном расходе биотоплива.
Горит не само топливо, а его пары. Размер отверстий решетки подобран таким образом, чтобы обеспечить оптимальный уровень огня, при экономичном расходе биотоплива.| В наличии на складе | Да |
| Характеристики | |
|---|---|
| Серия топливного блока | S-LINE |
| Производитель | SteelHeat |
| Страна производства | Россия |
| Гарантия | 10 лет |
| Материал ТБ | Нерж. сталь сталь |
| Топливо | Этанол |
| Класс расхода биотоплива | Высокий |
| Вид огня | Настоящий живой огонь |
| Цвет | Стальной |
| Количество контейнеров | Один |
| Толщина крышки топливного блока | 7 мм |
| Вес | 8.58 кг |
| Общая линия огня | 1100 мм |
| Ширина | 1200 мм |
| Высота | 65 мм |
| Глубина | 110 мм |
| Глубина встраиваемая | 90 мм |
| Ширина встраиваемая | 1180 мм |
| Высота встраиваемая | 61 мм |
| Объем топливного блока (л) | 5.79 |
| Объем заливаемого топлива (л) | 3.86 |
| Расход биотоплива (л/ч) | 0.97 |
| Максимальное время горения (ч) | 4 |
Электронный блок управления насосом Coelbo Compact 2 RMC S S311620
Описание
Электронный блок управления насосом Coelbo Compact 2 RMC S предназначен для управления однофазным насосом систем водоснабжения мощностью до 2,2 кВт 16 Ампер.
Контроллер управляет работой насоса путем старта по заданному давлению от 1,5 до 3,5 бар (регулируется на корпусе отверткой) и останавливает работу насоса при обнаружении отсутствия протока воды в трубопроводе в течении 10 секунд. Не требует программирования!
Защищает насос по сухому ходу (имеет автоматический перезапуск). Благодаря встроенному механическому манометру, легко настроить стартовое давление и контролировать его.
Встроенная в прибор мембрана предотвратит гидро удар в случае выхода из строя гидроаккумулятора. Кабели подключения к электрической сети и насосу, дают возможность не разбирая прибор быстро и качественно инсталлировать его. Встроенный обратный клапан, гидравлическое подключение 1″ н.р.
Чаще всего используется в системах водоснабжения дачных домов, коттеджей, систем орошения и полива, фермерских хозяйств и т.д.
Характеристики
| Автоматический перезапуск | Есть (Art) |
| Вес в упаковке, кг | 0. 900 900 |
| Встроенный обратный клапан | Есть |
| Высота в упаковке, мм | 160 |
| Гидравлическое подключение | 1″ н. р. in-line |
| Длина в упаковке, мм | 190 |
| Для однофазных насосов мощностью до, кВт | 2.2 |
| Защита от гидроудара | Есть |
| Защита от сухого хода | Есть |
| Индикация | Светодиодная |
| Класс защиты | IP65 |
| Материал корпуса | Пластик |
| Мощность коммутируемого контакта, А | 16 |
| Остановка насоса (по протоку), сек | 10 |
| Параметры питания сети, В/Гц | ~ 1x 230/50 |
| Положение установки контроллера | Только вертикально |
| Старт насоса (регулироемое давление), бар | 1. 5 – 3.5 5 – 3.5 |
| Ширина в упаковке, мм | 135 |
| Электрические кабели в комплекте | Есть |
Файлы
Отзывы (0)
Нет отзывов о данном товаре.
Ваше имя:
Минусы
Ваш отзыв:Примечание: HTML разметка не поддерживается! Используйте обычный текст.
Оценка: Плохо Хорошо
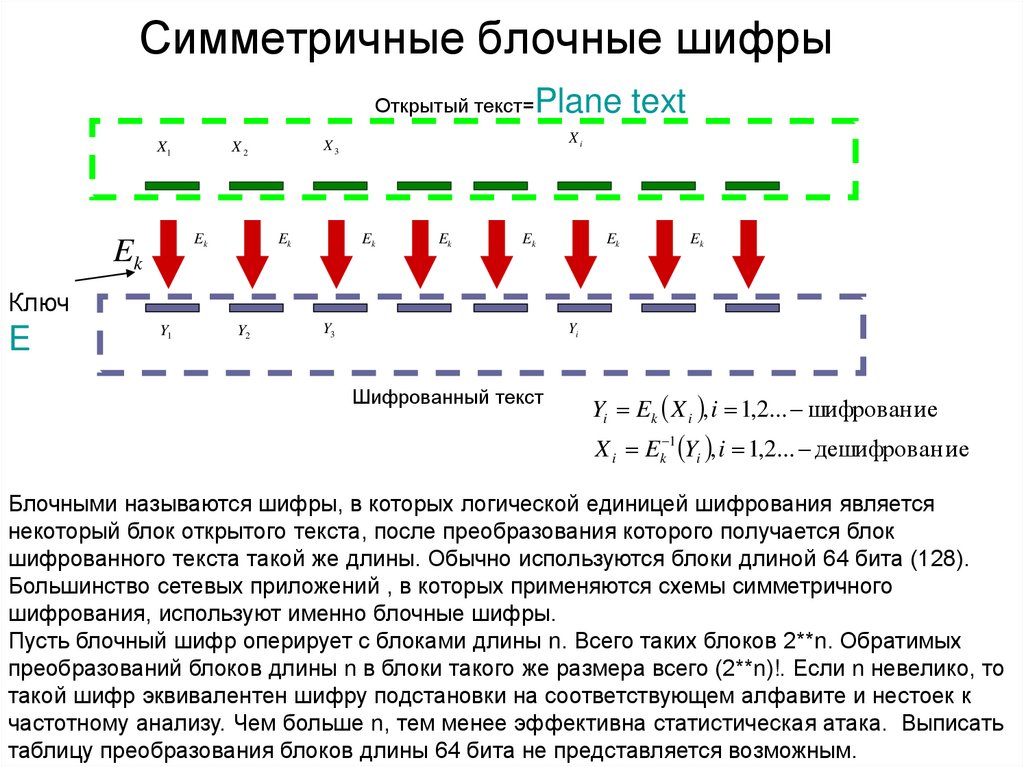
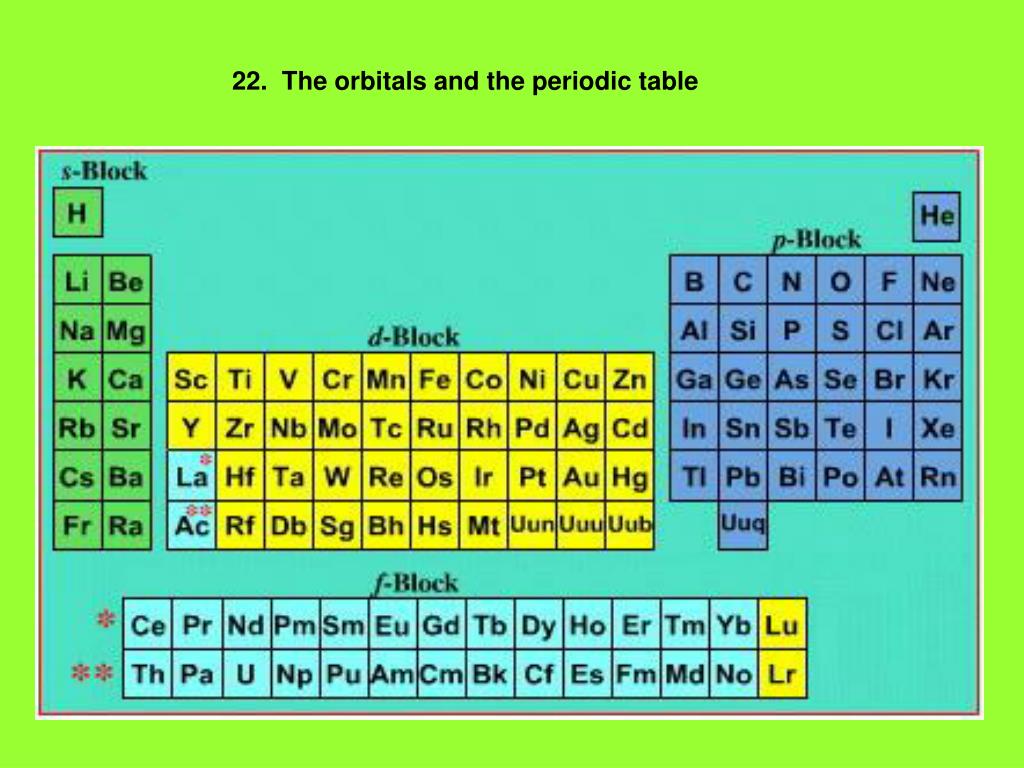
Элементы S-блока – свойства, периодические тренды, конфигурации
Элементы группы 1 и группы 2 современной периодической таблицы называются элементами S-блока . Возможны два типа s-блочных элементов: элементы с одним электроном (s1) или элементы с двумя электронами (s2) в их s-подоболочке.
Возможны два типа s-блочных элементов: элементы с одним электроном (s1) или элементы с двумя электронами (s2) в их s-подоболочке.
S-блок включает 14 элементов, , а именно водород (H), литий (Li), гелий (He), натрий (Na), бериллий (Be), калий (K), магний (Mg), рубидий (Rb) , кальций (Ca), цезий (Cs), стронций (Sr), франций (Fr), барий (Ba) и радий (Ra).
JEE Main 2021 LIVE Chemistry Paper Solutions 24 февраля Shift-1 На основе памяти
Руководство по блочным элементам S
- Что такое элементы блока?
- Электронная конфигурация
- Свойства элементов блока s
- Диагональные отношения
- Часто задаваемые вопросы
Что такое элементы S-блока?
Элементы S-блока, имеющие только один электрон на их s-орбитали, называются металлами первой группы или щелочными металлами, тогда как элементы s-блока, имеющие два электрона, заполняющих их s-орбиталь, называются металлами второй группы или щелочноземельными металлами .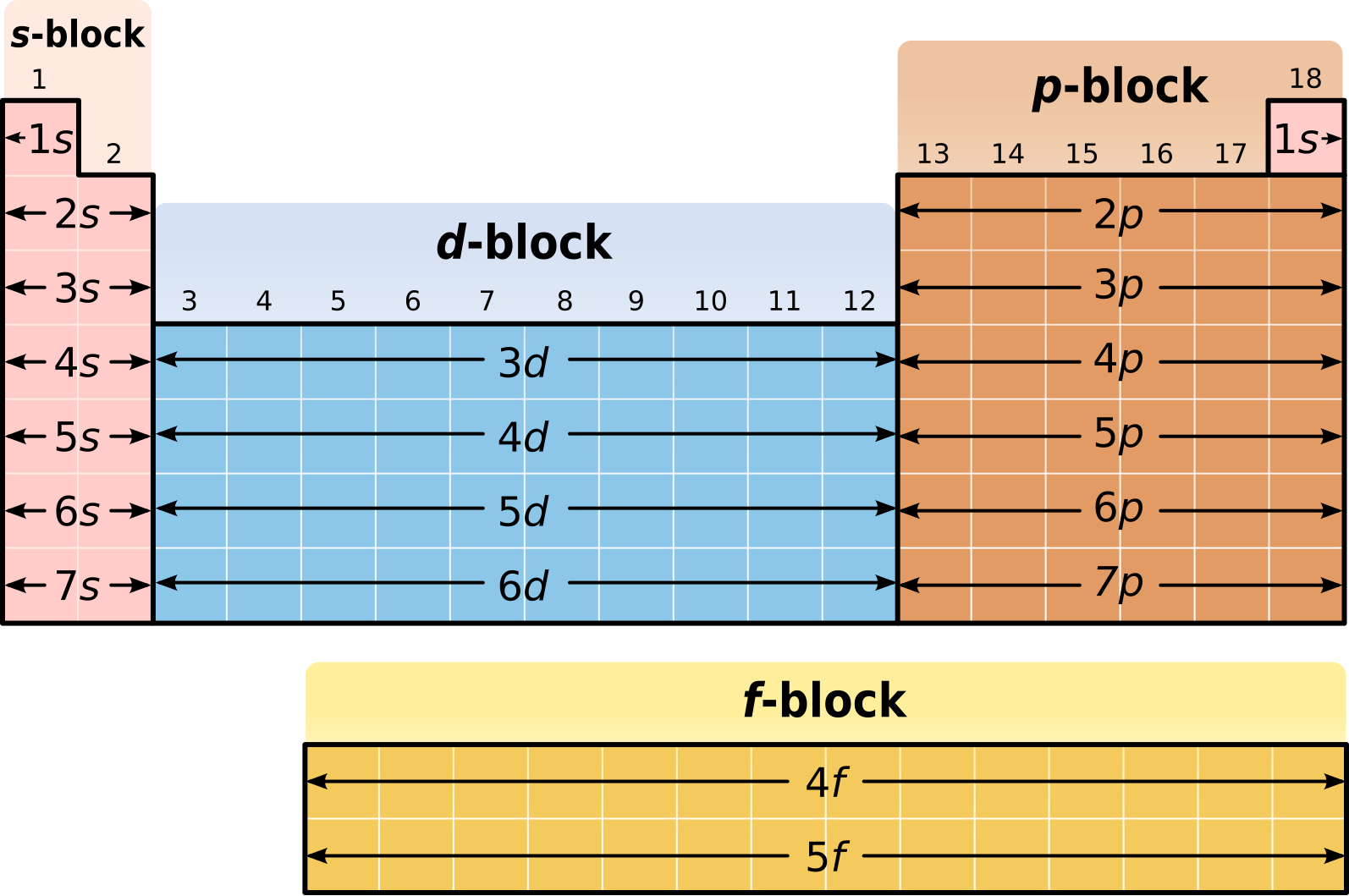
Электроны, присутствующие в атоме, занимают различные суборбитали доступных энергетических уровней в порядке возрастания энергии. Последний электрон атома может оказаться в любой из s, p, d и f подоболочек . Соответственно, элементы атома, у которых последний валентный электрон находится на s-суборбитали, называются s-блочными элементами.
Электронная конфигурация элементов S-блока
Электронная конфигурация элементов S-блока описана ниже.
Щелочные элементы в s-блоке состоят из одного валентного электрона на внешней оболочке. Этот крайний электрон удерживается слабо, что делает эти металлы очень электроположительными. В связи с этим они не доступны в свободном состоянии в природе. Общая электронная конфигурация элементов блока s – группа 1 показана в таблице ниже:
электронных конфигураций элементов, включенных в группу 2 элементов S-блока , показаны ниже:
Свойства элементов S-блока
Как щелочные, так и щелочноземельные элементы демонстрируют регулярную градацию своих свойств среди элементов соответствующих групп. Но первый член обоих элементов S-блока, а именно литий и бериллий, сильно отличаются от остальных своих членов, но в то же время они больше похожи с диагональным элементом, присутствующим в следующем столбце.
Но первый член обоих элементов S-блока, а именно литий и бериллий, сильно отличаются от остальных своих членов, но в то же время они больше похожи с диагональным элементом, присутствующим в следующем столбце.
Аномалия этих элементов S-блока обусловлена следующим:
- Малый размер атомов и ионов
- Большая плотность заряда (заряд/объем атома)
- Большая поляризация
- Отсутствие d-орбиталей.
Большая поляризация элементов s-блока делает первый элемент более ковалентным и отличает их от остальных, которые являются ионными.
Сходство по размеру и плотности заряда делает их похожими на элемент, расположенный по диагонали в следующей группе (диагональное соотношение).
Замечено, что физические и химические свойства этих s-элементов изменяются в определенном направлении по мере увеличения атомного номера элементов. Изменения в различных свойствах группы указаны ниже:
Химические свойства элементов s-блока
Атомные и ионные радиусы
При наблюдении элементов s-блока современной периодической таблицы видно, что размер щелочных металлов больше по сравнению с другими элементами в определенный период. По мере увеличения атомного номера общее количество электронов увеличивается вместе с добавлением оболочек.
По мере увеличения атомного номера общее количество электронов увеличивается вместе с добавлением оболочек.
При движении вниз по группе атомный номер увеличивается. В результате атомный и ионный радиусы щелочных металлов увеличиваются.
Энтальпия ионизации
По мере продвижения вниз по группе размер атомов увеличивается, из-за чего уменьшается притяжение между ядром и электронами в самой внешней оболочке. В результате энтальпия ионизации уменьшается. Энтальпия ионизации щелочных металлов сравнительно меньше, чем у других элементов.
Энтальпия гидратации
По мере увеличения размеров ионов элементов энтальпия гидратации уменьшается. Чем меньше размер иона, тем выше энтальпия гидратации, поскольку атом имеет возможность разместить вокруг себя большее количество молекул воды из-за высокого отношения заряда к радиусу и, следовательно, гидратируется.
Физические свойства элементов s-блока
- В элементах s-блока плотность щелочных металлов увеличивается вниз по группе.
 Исключение: плотность калия меньше плотности натрия.
Исключение: плотность калия меньше плотности натрия. - Щелочные металлы имеют низкую температуру плавления и кипения из-за слабой металлической связи.
- Щелочные металлы и их соответствующие соли обладают способностью окрашивать окислительное пламя за счет тепла, выделяемого пламенем, которое переводит валентные электроны с одного энергетического уровня на другой энергетический уровень. Это помогает в обнаружении щелочных металлов во время испытания пламенем.
Диагональная взаимосвязь внутри элементов блока s
Диагональная связь в элементах блока s существует между соседними элементами, которые расположены во втором и третьем периодах периодической таблицы. Например, литий группы 1А и второго периода проявляет сходство свойств со свойствами магния, которые находятся во 2-й группе и 3-м периоде .
Аналогично свойства бериллия, находящегося во 2-й группе и 2-м периодах, обнаруживают сходство со свойствами алюминия, находящегося в третьем периоде и 3-й группе.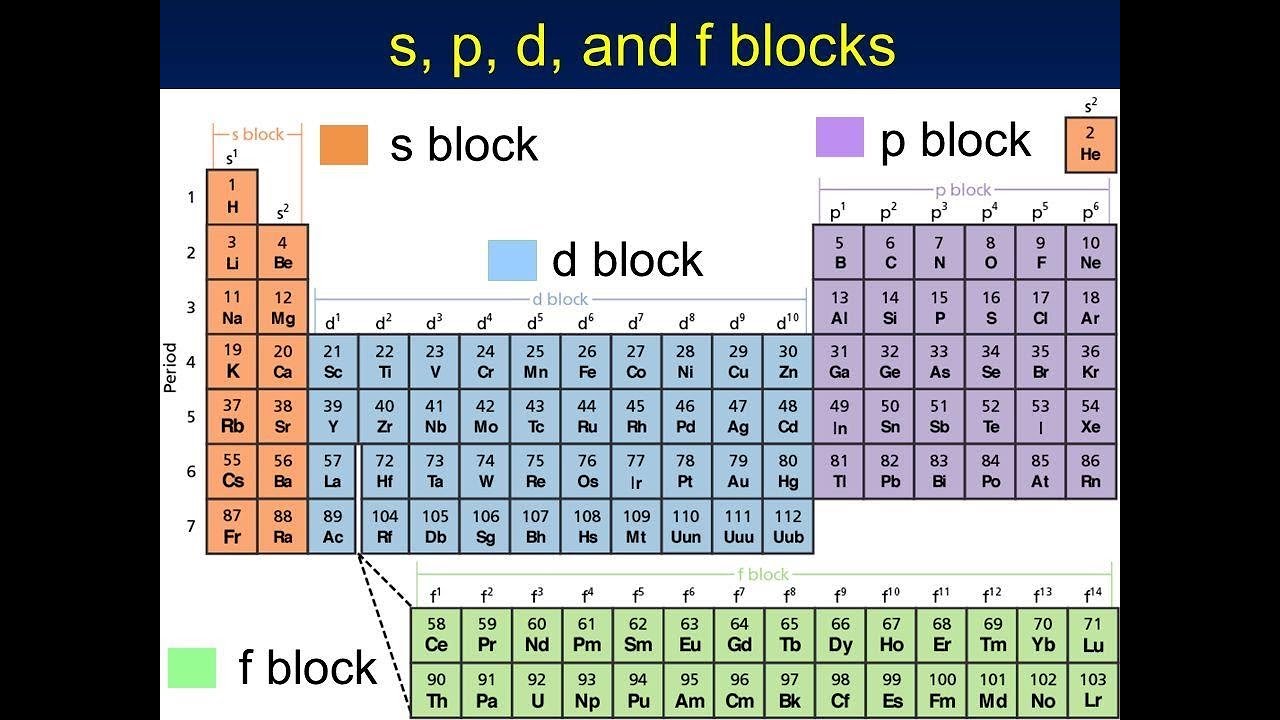 Два элемента, которые обнаруживают сходство в своих свойствах, можно назвать 9.0003 диагональные пары или диагональные соседи .
Два элемента, которые обнаруживают сходство в своих свойствах, можно назвать 9.0003 диагональные пары или диагональные соседи .
Свойства элементов блока s значительно различаются по сравнению с другими элементами подгруппы, к которой они принадлежат. Соседи по диагонали очень похожи на . Такая взаимосвязь проявляется, когда вы двигаетесь слева направо и вниз по группе; периодическая таблица имеет противоположные факторы.
Например, электроотрицательность элементов s-блока увеличивается по мере прохождения периода и уменьшается по мере продвижения вниз по группе. Поэтому при его перемещении по диагонали противоположные тенденции нейтрализуются, и значение электроотрицательности почти остается прежним.
Сходства между литием и магнием
- Твердость лития и магния выше, чем у других элементов в соответствующих группах.
- Хлориды лития и магния обладают способностью растворяться в этаноле.
- Они легче по сравнению с другими элементами в своих группах.

- Литий и магний мягко реагируют с водой. Оксиды и гидроксиды менее растворимы.
- В присутствии азота литий и магний образуют соответствующие нитриды.
- Супероксиды не образуются при взаимодействии лития и магния с избытком кислорода.
- Углекислый газ и его соответствующие оксиды образуются при нагревании карбонатов магния и лития.
Сходства между бериллием и алюминием
- Гидроксид алюминия и гидроксид бериллия реагируют с избытком щелочи с образованием соответствующих ионов.
- Оба эти элемента обладают способностью противостоять кислотному воздействию благодаря наличию оксидной пленки на поверхности металла.
- Оба этих металла склонны образовывать комплексы.
- Хлориды обоих этих металлов обладают способностью растворяться в органических растворителях.
Часто задаваемые вопросы по элементам блока s
Q1
Первый элемент элементов блока s значительно отличается от остальных.
 Почему?
Почему?Литий и бериллий, первые члены семейства s-блоков, сильно отличаются от остальных своих членов. Аномальность этих элементов обусловлена их,
- Низкий атомный и ионный размер
- Большая плотность заряда (заряд/объем атома)
- Большая поляризация
- Отсутствие d-орбиталей.
⇒ Проверить: Получение и свойства перекиси водорода
Большая поляризация заставляет первый элемент образовывать ковалентные соединения по сравнению с остальными, которые являются ионными.
Q2
Будет ли разница в свойствах между оксидами натрия и цезия 1-й группы и соединениями магния и бария 2-й группы? Приведите пример.
Натрий и магний образуют оксиды с более низкими степенями окисления, тогда как более тяжелые атомы образуют оксиды с более высокими степенями окисления. Натрий образует оксид и пероксид, тогда как кислород имеет степень окисления -2 и -1 соответственно.
⇒ Читайте также: Свойства элементов d блока
В оксиде магния кислород находится в состоянии -2. Но цезий образует супероксиды, где степень окисления кислорода – 0,5. Точно так же более тяжелый барий образует перекись со степенью окисления кислорода -1.
Но цезий образует супероксиды, где степень окисления кислорода – 0,5. Точно так же более тяжелый барий образует перекись со степенью окисления кислорода -1.
Q3
Ковалентный сульфат бериллия растворим в воде, тогда как ионный сульфат бария нерастворим в воде. Почему?
Растворимость зависит от двух факторов:
- Разрыв связей с образованием ионных образований
- Энергия сольватации (энергия гидратации) образований за счет ионных взаимодействий.
⇒ Узнать больше:
- Актиниды
- Лантаниды
- F Блочные элементы
Ковалентные соединения, такие как сульфат бериллия, имеют более высокую энтальпию диссоциации, чем ионный сульфат бария. Но более мелкие объекты, такие как бериллий, имеют более высокую плотность заряда, что приводит к более высокой сольватации, и, следовательно, выделение энтальпии гидратации больше, чем энергия диссоциации.
Итак, BeSO 4 более растворим, чем ионный BaSO 4 .
Q4
Элементы блока S получают электролизом, а не восстановлением их соединений другими элементами группы или их соединениями. Какой восстановитель самый сильный?
Элементы S-блока являются сильными электроположительными элементами с низким восстановительным потенциалом, что указывает на их сильную восстановительную способность по сравнению с другими. Так, вещества, обладающие меньшей восстановительной способностью, чем они, не смогут их восстановить. Восстановительная способность атома связана с легкостью высвобождения электронов для восстановления. Уменьшение энергии ионизации вниз по колонке предполагает, что цезий является более сильным восстановителем, чем литий.
Но восстановительная способность (окислительный потенциал) зависит от суммарной разности энергий трех процессов:
- Возгонка атома
- Ионизация ионом металла
- Гидратация иона водой
Литий, будучи наименьшим ионом, имеет очень высокую энтальпию гидратации, чем цезий, и компенсирует более высокую энтальпию ионизации. Таким образом, литий обладает самой высокой восстановительной способностью (самый высокий потенциал окисления или самый низкий потенциал восстановления = -3,04 В) по сравнению с цезием.
Таким образом, литий обладает самой высокой восстановительной способностью (самый высокий потенциал окисления или самый низкий потенциал восстановления = -3,04 В) по сравнению с цезием.
Q5
Есть ли простой способ определить наличие элементов блока s?
Элементы S-блока или их галогениды при воздействии пламени претерпевают электронные переходы в видимой области светового спектра. Следовательно, они вызывают характерный цвет пламени. Цвета следующие:
| Металлы | Литий | Натрий | Калий | Рубидий | Цезий |
| Цвет пламени | малиново-красный | Желтый | Фиолетовый | Красно-фиолетовый | Синий |
| Металлы | Бериллий | Магний | Кальций | Стронций | Барий |
| Цвет пламени | – | – | Кирпично-красный | малиново-красный | Яблочно-зеленый |
Элементы s-block – важные темы
Элементы s-блока – важные вопросы
Элементы s-блока и p-блока
Элементы d-блока и f-блока
Блок— Простая английская Википедия, бесплатная энциклопедия
Из Простая английская Википедия, бесплатная энциклопедия
Английский язык, используемый в этой статье или разделе , может быть не всем легко понять . |
| Группа | 1 | 2 | 18 |
|---|---|---|---|
| Период | |||
| 1 | 1 Н | 2 Он | |
| 2 | 3 Ли | 4 Бе | |
| 3 | 11 Нет | 12 мг | |
| 4 | 19 К | 20 Ка | |
| 5 | 37 руб. | 38 старший | |
| 6 | 55 Цс | 56 Ба | |
| 7 | 87 Пт | 88 Ра |
S-блок — один из четырех блоков элементов периодической таблицы. Элементы s-группы обладают общим свойством. Электрон в своей самой внешней электронной оболочке находится на s-орбитали. [1] Элементы s- входят в первые две группы таблицы Менделеева. [2] Элементы первой группы называются щелочными металлами. Элементы второй группы называются щелочноземельными металлами.
Элементы s-группы обладают общим свойством. Электрон в своей самой внешней электронной оболочке находится на s-орбитали. [1] Элементы s- входят в первые две группы таблицы Менделеева. [2] Элементы первой группы называются щелочными металлами. Элементы второй группы называются щелочноземельными металлами.
Современный периодический закон гласит, что «Свойства элементов являются периодической функцией их атомного номера». Это означает, что некоторые свойства элементов повторяются по мере увеличения атомного номера элемента. Эти повторяющиеся свойства использовались для разделения элементов на четыре s. Это s-, p-, d- и f-.
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Все s-элементы являются металлами (кроме водорода). В целом они блестящие, серебристые, хорошие проводники тепла и электричества. Они легко теряют свои валентные электроны. Фактически, они настолько легко теряют свои фирменные s орбитальные валентные электроны, что s-элементы являются одними из самых реакционноспособных элементов в периодической таблице.
В целом они блестящие, серебристые, хорошие проводники тепла и электричества. Они легко теряют свои валентные электроны. Фактически, они настолько легко теряют свои фирменные s орбитальные валентные электроны, что s-элементы являются одними из самых реакционноспособных элементов в периодической таблице.
Элементы группы 1, известные под общим названием щелочные металлы (кроме водорода), всегда теряют один валентный электрон, образуя ион +1. Эти металлы имеют серебристый цвет, очень мягкие, не очень плотные и имеют низкие температуры плавления. Эти металлы чрезвычайно энергично реагируют с водой и даже с кислородом с образованием энергии и легковоспламеняющегося газообразного водорода. Они хранятся в минеральном масле, чтобы уменьшить вероятность нежелательной реакции или, что еще хуже, взрыва.
Элементы группы 2, известные как щелочноземельные металлы (кроме гелия), всегда теряют два своих валентных электрона, образуя ион +2. Как и щелочные металлы, щелочноземельные металлы серебристые, блестящие и относительно мягкие. Некоторые элементы в этой колонке также энергично реагируют с водой и должны храниться с осторожностью.
Некоторые элементы в этой колонке также энергично реагируют с водой и должны храниться с осторожностью.
Элементы S известны тем, что являются ингредиентами фейерверков. Ионные формы калия, стронция и бария появляются на фейерверках в ярко-фиолетовых, красных и зеленых тонах.
Франций считается самым редким природным элементом на Земле. Подсчитано, что на Земле одновременно присутствует только один природный атом франция. Франций имеет очень нестабильное ядро и быстро подвергается ядерному распаду.
Химические свойства щелочных металлов
1. Щелочные металлы реагируют с сухим водородом с образованием гидридов.
а. Эти гидриды имеют ионную природу
b.Эти гидриды щелочных металлов реагируют с водой с образованием соответствующих гидроксидов и газообразного водорода.
LiH+ H 2 O->LiOH+H 2
c. Эти гидриды являются сильными восстановителями, и их восстановительная природа увеличивается вниз по группе.
d. Щелочные металлы также образуют сложные гидриды, такие как LiAlH 4 , который является хорошим восстановителем. Гидриды щелочных металлов не существуют в воде, и эта реакция с любым другим агентом проводится в протонном растворителе.
e. Плавленые гидриды щелочных металлов при электролизе образуют газ H 2 на аноде.
2. Образование оксидов и гидроксидов.
а. Это наиболее активные металлы и имеют сильное сродство к O 2 , они образуют оксиды на поверхности. Их хранят под керосином или парафиновым маслом для защиты от воздуха.
b.При сгорании на воздухе (O 2 ) li образует Li 2 0, Na образует Na 2 O 2 , а другие щелочные металлы образуют супероксиды.
3. Они являются чисто металлическими, так как легко теряют электроны с самой внешней оболочки, они являются высокореактивными металлами и имеют низкую энергию ионизации.
4. Бериллий амфотерен по своей природе.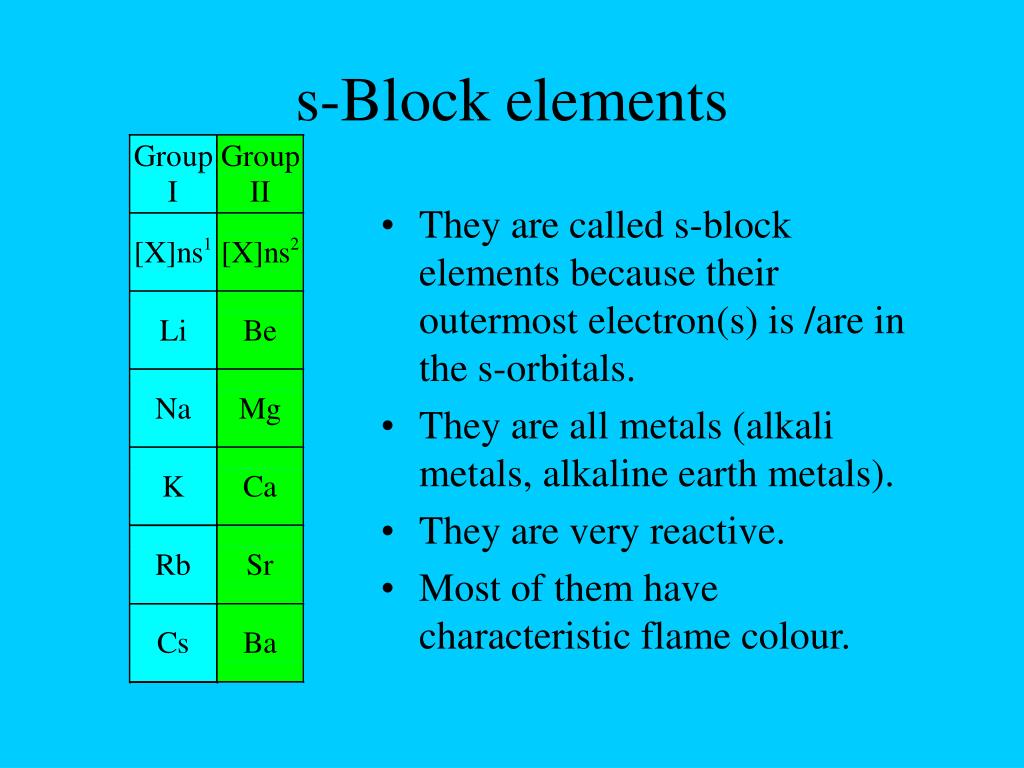
| Группа | 1 | 2 | 13 | 14 |
|---|---|---|---|---|
| Период 2 | Ли | Быть | Б | С |
| Период 3 | На | мг | Ал | Си |
Первый элемент первой группы, литий, и первый элемент второй группы, бериллий, ведут себя иначе, чем другие элементы своих групп. Их поведение похоже на второй элемент следующей группы. Так литий подобен магнию, а бериллий подобен алюминию. [ источник? ]
В периодической таблице это известно как «диагональное соотношение». Диагональные отношения возникают из-за сходства размеров ионов и отношения заряда к радиусу элемента. Сходство между литием и магнием связано с их схожими размерами: [ источник? ]
- Радиусы, Li=152pm Mg=160pm
Литий[изменить | изменить источник]
Литий ведет себя по-разному по сравнению с другими элементами первой группы. Эта разница вызвана:
Эта разница вызвана:
- малый размер атома лития и его иона.
- более высокая мощность поляризации li
+ (т.е. отношение величины заряда). Это означает повышенный ковалентный характер его соединений, что обуславливает их растворимость в органических растворителях - высокая энтальпия ионизации и высокая электроотрицательность лития по сравнению с другими щелочными металлами
- отсутствие d-орбиталей в его валентной оболочке
- сильная интерметаллическая связь
Некоторые из способов, которыми литий ведет себя иначе, чем другие члены:
- Литий тверже, чем натрий и калий, которые настолько мягки, что их можно порезать ножом.
- Температура плавления и кипения лития выше.
- Литий с кислородом образует монооксид, другие щелочи образуют пероксид и супероксид.
- Литий соединяется с азотом с образованием нитридов, тогда как другие щелочные металлы этого не делают.


 Исключение: плотность калия меньше плотности натрия.
Исключение: плотность калия меньше плотности натрия.
 Вы можете помочь Википедии, прочитав Wikipedia:Как писать страницы на простом английском, а затем упростив статью. (февраль 2012 г.)
Вы можете помочь Википедии, прочитав Wikipedia:Как писать страницы на простом английском, а затем упростив статью. (февраль 2012 г.)