Расчеты при приготовлении водных растворов
Приблизительные растворы. При приготовлении приблизительных растворов количества веществ, которые должны быть взяты для этого, вычисляют с небольшой точностью. Атомные веса элементов для упрощения расчетов допускается брать округленными иногда до целых единиц. Так, для грубого подсчета атомный вес железа можно принять равным 56 вместо точного —55,847; для серы — 32 вместо точного 32,064 и т. д.
Вещества для приготовления приблизительных растворов взвешивают на технохимических или технических весах.
Принципиально расчеты при приготовлении растворов совершенно одинаковы для всех веществ.
Количество приготовляемого раствора выражают или в единицах массы (г, кг), или в единицах объема (мл, л), причем для каждого из этих случаев вычисление количества растворяемого вещества проводят по-разному.
Пример. Пусть требуется приготовить 1,5 кг 15%-ного раствора хлористого натрия; предварительно вычисляем требуемое количе-ство соли.
т. е. если в 100 г раствора содержится 15 г соли (15%), то сколько ее потребуется для приготовления 1500 г раствора?
Расчет показывает, что нужно отвесить 225 г соли, тогда воды иужио взять 1500 — 225 = 1275 г. ¦
Если же задано получить 1,5 л того же раствора, то в этом случае по справочнику узнают его плотность, умножают последнюю на заданный объем и таким образом находят массу требуемого количества раствора. Так, плотность 15%-нoro раствора хлористого натрия при 15 0C равна 1,184 г/см3. Следовательно, 1500 мл составляет
Следовательно, количество вещества для приготовления 1,5 кг и 1,5 л раствора различно.
Расчет, приведенный выше, применим только для приготовления растворов безводных веществ. Если взята водная соль, например Na2SO4-IOh3O1 то расчет несколько видоизменяется, так как нужно принимать во внимание и кристаллизационную воду.
Пример. Пусть нужно приготовить 2 кг 10%-ного раствора Na2SO4, исходя из Na2SO4 *10h3O.
Молекулярный вес Na2SO4 равен 142,041, a Na2SO4*10h3O 322,195, или округленно 322,20.
Расчет ведут вначале па безводную соль:
Следовательно, нужно взять 200 г безводной соли. Количество десятиводной соли находят из расчета:
Воды в этом, случае нужно взять: 2000 — 453,7 =1546,3 г.
Так как раствор не всегда готовят с пересчетом на безводную соль, то на этикетке, которую обязательно следует наклеивать на сосуд с раствором, нужно указать, из какой соли приготовлен раствор, например 10%-ный раствор Na2SO4 или 25%-ный Na2SO4*10h3O.
Часто случается, что приготовленный ранее раствор нужно разбавить, т. е. уменьшить его концентрацию; растворы разбавляют или по объему, или по массе.
Пример. Нужно разбавить 20%-ный раствор сернокислого аммония так, чтобы получить 2 л 5%-иого раствора. Расчет ведем следующим путем. По справочнику узнаем, что плотность 5%-ного раствора (Nh5)2SO4 равна 1,0287 г/см3. Следовательно, 2 л его должны весить 1,0287*2000 = 2057,4 г.
Теперь можно подсчитать, сколько нужно взять 20%-ного рас* твора, чтобы получить 2 л 5%-ного раствора.
Полученную массу раствора можно пересчитать на объем его. Для этого массу раствора делят на его плотность (плотность 20%-ного раствора равна 1.1149 г/см3), т. е.
Учитывая, что при отмеривании могут произойти потери, нужно взять 462 мл и довести их до 2 л, т. е. добавить к ним 2000—462 = = 1538 мл воды.
Если же разбавление проводить по массе, расчет упрощается. Но вообще разбавление проводят из расчета на объем, так как жидкости, особенно в больших количествах, легче отмерить по объему, чем взвесить.
Нужно помнить, что при всякой работе как с растворением, так и с разбавлением никогда не следует выливать сразу всю воду в сосуд. Водой ополаскивают несколько раз ту посуду, в которой проводилось взвешивание или отмеривание нужного вещества, и каждый раз добавляют эту воду в сосуд для раствора.
Когда не требуется особенной точности, при разбавлении растворов или смешивании их для получения растворов другой концентрации можно пользоваться следующим простым и быстрым способом.
Возьмем разобранный уже случай разбавления 20%-ного раствора сернокислого аммония до 5%-ного. Пишем вначале так:
где 20 — концентрация взятого раствора, 0 — вода и 5’—-требуемая концентрация. Теперь из 20 вычитаем 5 и полученное значение пишем в правом нижнем углу, вычитая же нуль из 5, пишем цифру в правом верхнем углу. Тогда схема примет такой вид:
Это значит, что нужно взять 5 объемов 20%-ного раствора и 15 объемов воды. Конечно, такой расчет не отличается точностью.
Если смешивать два раствора одного и того же вещества, то схема сохраняется та же, изменяются только числовые значения. Пусть смешением 35%-ного раствора и 15%-ного нужно приготовить 25%-ный раствор. Тогда схема примет такой вид:
т. е. нужно взять по 10 объемов обоих растворов. Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Эта схема дает приблизительные результаты и ею можно пользоваться только тогда, когда особой точности не требуется.Для всякого химика очень важно воспитать в себе привычку к точности в вычислениях, когда это необходимо, и пользоваться приближенными цифрами в тех случаях, когда это не повлияет на результаты работы.Когда нужна большая точность при разбавлении растворов, вычисление проводят по формулам.
Разберем несколько важнейших случаев.
Приготовление разбавленного раствора. Пусть с — количество раствора, m%—концентрация раствора, который нужно разбавить до концентрации п%. Получающееся при этом количество разбавленного раствора х вычисляют по формуле:
а объем воды v для разбавления раствора вычисляют по формуле:
Смешивание двух растворов одного и того же вещества различной концентрации для получения раствора заданной концентрации. Пусть смешиванием а частей m%-ного раствора с х частями п%-ного раствора нужно получить /%-ный раствор, тогда:
Точные растворы. При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
При приготовлении точных растворов вычисление количеств нужных веществ проверят уже с достаточной степенью точности. Атомные весы элементов берут по таблице, в которой приведены их точные значения. При сложении (или вычитании) пользуются точным значением слагаемого с наименьшим числом десятичных знаков. Остальные слагаемые округляют, оставляя после запятой одним знаком больше, чем в слагаемом с наименьшим числом знаков. В результате оставляют столько цифр после запятой, сколько их имеется в слагаемом с наименьшим числом десятичных знаков; при этом производят необходимое округление. Все расчеты производят, применяя логарифмы, пятизначные или четырехзначные. Вычисленные количества вещества отвешивают только на аналитических весах.
Взвешивание проводят или на часовом стекле, или в бюксе. Отвешенное вещество высыпают в чисто вымытую мерную колбу через чистую сухую воронку небольшими порциями. Затем из промывалки несколько раз небольшими порциями воды обмывают над воронкой бнже или часовое стекло, в котором проводилось взвешивание. Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Воронку также несколько раз обмывают из промывалки дистиллированной водой.
Для пересыпания твердых кристаллов или порошков в мерную колбу очень удобно пользоваться воронкой, изображенной на рис. 349. Такие воронки изготовляют емкостью 3, 6, и 10 см3. Взвешивать навеску можно непосредственно в этих воронках (негигроскопические материалы), предварительно определив их массу. Навеска из воронки очень легко переводится в мерную колбу. Когда навеска пересыпается, воронку, не вынимая из горла колбы, хорошо обмывают дистиллированной водой из промывалки.
Как правило, при приготовлении точных растворов и переведении растворяемого вещества в мерную колбу растворитель (например, вода) должен занимать не более половины емкости колбы. Закрыв пробкой мерную колбу, встряхивают ее до полного растворения твердого вещества. После этого полученный раствор дополняют водой до метки и тщательно перемешивают.
Молярные растворы. Для приготовления 1 л 1 M раствора какого-либо вещества отвешивают на аналитических весах 1 моль его и растворяют, как указано выше.
Пример. Для приготовления 1 л 1 M раствора азотнокислого серебра находят в таблице или подсчитывают молекулярную массу AgNO3, она равна 169,875. Соль отвешивают и растворяют в воде.
Если нужно приготовить более разбавленный раствор (0,1 или 0,01 M), отвешивают соответственно 0,1 или 0,01 моль соли.
Если же нужно приготовить меньше 1 л раствора, то растворяют соответственно меньшее количество соли в соответствущем объеме воды.
Нормальные растворы готовят аналогично, только отвешивая не 1 моль, а 1 грамм-эквивалент твердого вещества.
Если нужно приготовить полунормальный или децинормальный раствор, берут соответственно 0,5 или 0,1 грамм-эквивалента. Когда готовят не 1 л раствора, а меньше, например 100 или 250 мл, то берут1/10 или 1/4 того количества вещества, которое требуется для приготовления I л, и растворяют в соответствующем объеме воды.
Рис 349. Воронки для пересыпания навески а колбу.
После приготовления раствора его нужно обязательно проверить титрованием соответствующим раствором другого вещества с известной нормальностью. Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
Приготовленный раствор может не отвечать точно той нормальности, которая задана. В таких случаях иногда вводят поправку.
В производственных лабораториях иногда готовят точные растворы «по определяемому веществу». Применение таких растворов облегчает расчеты при анализах, так как достаточно умножить объем раствора, пошедший на титрование, на титр раствора, чтобы получить содержание искомого вещества (в г) во взятом для анализа количестве какого-либо раствора.
Расчет при приготовлении титрованного раствора по определяемому веществу ведут также по грамм-эквиваленту растворяемого вещества, пользуясь формулой:
Пример. Пусть нужно приготовить 3 л раствора марганцовокислого калия с титром по железу 0,0050 г/мл. Грамм-эквивалент KMnO4 равен 31,61., а грамм-эквивалент Fe 55,847.
Вычисляем по приведенной выше формуле:
Стандартные растворы. Стандартными называют растворы с разными, точно определенными концентрациями, применяемые в колориметрии, например растворы, содержащие в 1 мл 0,1, 0,01, 0,001 мг и т. д. растворенного вещества.
д. растворенного вещества.
Кроме колориметрического анализа, такие растворы бывают нужны при определении рН, при нефелометрических определениях и пр. Иногда стандартные растворы” хранят в запаянных ампулах, однако чаще приходится готовить их непосредственно перед применением. Стандартные растворы готовят в объеме не больше 1 л, а ча ще — меньше. Только при большом расходе стандартного раствори можно готовить несколько литров его и то при условии, что стандартный раствор не будет храниться длительный срок.
Количество вещества (в г), необходимое для получения таких растворов, вычисляют по формуле:
Пример. Нужно приготовить стандартные растворы CuSO4 • 5h3O для колориметрического определения меди, причем в 1 мл первого раствора должно содержаться 1 мг меди, второго — 0,1 мг, третьего —0,01 мг, четвертого — 0,001 мг. Вначале готовят достаточное количество первого раствора, например 100 мл.
В данном случае Mi = 249,68; АСu = 63,54; следовательно, для приготовления 100 мл раствора, 1 мл которого содержал бы 1 мг меди (Т = 0,001 г/мл), нужно взять
Навеску соли переносят в мерную колбу емкостью 100 мл и добавляют воду до метки. Другие растворы готовят соответствующим разбавлением приготовленного.
Другие растворы готовят соответствующим разбавлением приготовленного.
Эмпирические растворы. Концентрацию этих растворов чаще всего выражают в г/л или г/мл. Для приготовления эмпирических растворов применяют очищенные перекристаллизацией вещества или реактивы квалификации ч. д. а. или х. ч.
Пример. Нужно приготовить 0,5 л раствора CuSO4, содержашего Cu 10 мг/мл. Для приготовления раствора применяют CuSO4 • 5h3O.
Чтобы подсчитать, сколько следует взять этой солн для приготовления раствора заданного объема, подсчитывают, сколько Cu должно содержаться в нем. Для этого объем умножают на заданную концентрацию, т. е.
500*10 = 5000 мг, или 5,0000 г
После этого, зная молекулярный вес соли, подсчитывают нужное количество ее:
На аналитических весах отвешивают в бюксе точно 19,648 г чистой соли, переводят ее в мерную колбу емкостью 0,5 л. Растворение проводят, как указано выше.
К оглавлению
см. также
также
- Основные понятия о растворах
- Классификация растворов
- Концентрация растворов
- Техника приготовления растворов
- Расчеты при приготовлении водных растворов
- Растворы солей
- Растворы щелочей
- Растворы кислот
- Фиксаналы
- Некоторые замечания о титровании и точных растворах
- Расчеты при титровании с помощью весовых бюреток
- Рациональные величины
- Растворение жидкостей
- Растворение газов
- Индикаторы
- Автоматическое титрование
- Неводные растворы
- Растворение в органических растворителях
- Обесцвечивание растворов
Пропорции раствора для тротуарной плитки
Как сделать раствор для тротуарной плитки – этот вопрос может возникнуть в процессе ремонта частного дома, точнее ландшафтного оформления двора. В итоге смешивания определенных компонентов получается смесь бетона, которую можно легко приготовить самостоятельно. Однако при этом необходимо четко следовать всем указаниям и соблюдать правила. В процессе смешивания раствора необходимые условия – чистота, а также поддержание нужной влажности и температурного режима.
В итоге смешивания определенных компонентов получается смесь бетона, которую можно легко приготовить самостоятельно. Однако при этом необходимо четко следовать всем указаниям и соблюдать правила. В процессе смешивания раствора необходимые условия – чистота, а также поддержание нужной влажности и температурного режима.
Если вы приготовите кашицу своими руками, это даст вам возможность провести некий эксперимент с цветами, а также с внешним видом плитки в плане формы. При этом форма для будущих элементов может быть также сделана своими руками. Используются самые разные геометрические фигуры.
Чаще всего:
- квадрат
- прямоугольник (в том числе с узорными краями)
- овал
- ромб
Чтобы реализовать замысел создания раствора, смеси под плитку, нужно взять смесь из полиуретана и форму, например, плитку или гипс. Для того чтобы комфортно работать с материалом, хватит 10 форм.
И все же пока рано приступать к подготовке самого раствора. Перед этим подготавливается вибростол, у которого должна быть четко ровная поверхность.
Приспособление изготавливают из разных материалов – это может быть деревянная основа, силиконовая, пенопласт, полиуретан и другие материалы. Кроме того, понадобится масляное вещество, которым нужно будет смазать формы. В качестве смазки можно использовать подсолнечное или пальмовое масла, а также подойдут даже старые моторные масла, которые уже отработали и не пригодятся автовладельцу.
Как приготовить раствор для тротуарной плитки
Состав раствора включает в себя несколько компонентов – это и материалы для получения бетона, и жидкие вещества. Итак, приготовление раствора для плитки происходит за счет размешивания в одной таре:
- цемента (чаще всего специалисты советуют использовать материал белого цвета)
- дистиллированной воды
- мелкофракционного речного песка (он должен быть просеян)
- пластификатора, который придает пластичность материалу
- гранитного щебня (фракция должна быть три-пять миллиметров)
- жидкого пигмента
- диспергатора, который делает смесь морозоустойчивой
Последний компонент (это относится и к пигментам) можно добавлять при желании, это не является обязательным условием.
Приготовить плиточный раствор: пропорции
Очень важно соблюсти верные пропорции – только в этом случае получится качественный раствор для плитки. Итак, в состав бетона для тротуарной плитки должны войти материалы в следующем процентном соотношении:
- цемента – 23
- щебня – 57
- песка – 20
- воды – 40 (имеется в виду от количества сухих компонентов)
- пигмента (700 мл)
- пластификатора – 0,5 (имеется в виду от количества цемента)
- диспергатора (90 г)
Когда готовится раствор для тротуарной плитки, пропорции сухих компонентов нужно ввести особым способом. Воду мы считаем от количества этих компонентов, а пластификатор рассчитываем, соотнеся его с объемами цемента. Диспергаторы и пигменты добавляем, растворяя вещества водой. Чтобы сделать один квадратный метр готового изделия, необходимо затратить приблизительно порядка 20 кг цемента, примерно столько же песка, 54-55 кг щебня, около 10 л воды и порядка 100 г пластификатора. В результате получится изделие толщиной 4-5 см.
В результате получится изделие толщиной 4-5 см.
Изготовление растворов под плитку тротуарную: порядок действий
В самом начале необходимо очень хорошо перемешивать песок, цемент и пластификатор. Затем идет добавление щебня, а жидкость доливают уже в самом конце, причем мелкими дозами. Если пропорции были соблюдены верно, раствор получится довольно плотный и будет хорошо держаться на инструменте. Он не должен разливаться или крошиться. Если же состав раствора для тротуарной плитки был неверным, или мастер нарушил технологию его изготовления, масса может начать растекаться. Если мы получаем слишком твердый раствор для тротуарной плитки, пропорции также были не соблюдены.
Самый надежный способ – замешивать раствор с помощью бетономешалки. Еще одним методом может быть использование строительного миксера. Это профессиональные способы, но если таких возможностей нет, можно обойтись и подручными средствами, например, подойдет обычный мастерок. Просто такой способ изготовления растворов под уличную плитку потребует больше сил и времени.
Если же вы решили, что не хотите самостоятельно заниматься приготовлением состава для тротуарной плитки, можно обратиться к профессионалам.
Заливка бетона в специальные формы
Перед тем как придать подготовленному составу конечную форму, надо дать смеси настояться.
Далее необходимо следовать алгоритму:
- разложить формы на столе (вибростол)
- смазать изделия маслянистой жидкостью, используя кисточку или губку
- убрать лишнее масло салфеткой
- залить раствор для тротуарной плитки (пропорции в данном случае определяются формой, масса заливается ровными слоями)
Необходимо знать некоторые секреты заливки. Если нужно, чтобы получился насыщенный цвет, лучше заливать в несколько слоев. Если необходимо получить эффект мрамора, нужно заливать один за другим два цвета.
После заполнения форм нужно их простучать (провибрировать) в течение нескольких минут, затем осуществить выравнивание на поверхности, накрыть пленкой и дать бетону, раствору засохнуть. Чаще всего высыхание бетона занимает один-два дня. При этом очень важно соблюдать определенную температуру. Профессионалы говорят, что температурный режим должен составлять 15-25 градусов.
Чаще всего высыхание бетона занимает один-два дня. При этом очень важно соблюдать определенную температуру. Профессионалы говорят, что температурный режим должен составлять 15-25 градусов.
Проблемы при изготовлении тротуарной плитки
Если пропорции были соблюдены не до конца, могут возникнуть самые разные проблемы.
Среди них:
- краска может сбиться (в этом случае может исчезнуть эффект мрамора). Это происходит, когда постукивание проводили слишком долго
- тротуарную плитку трудно разъединить с формой. Такая проблема может возникнуть из-за того, что мастер использовал недостаточно смазочного материала
- образуются пузыри и пустоты. Значит, изделие плохо простучали и в бетоне задержались воздушные пузыри. Также проблема могла возникнуть из-за того, что мастер слишком много использовал смазки
- материал ломается. Чаще всего такая проблема возникает по причине того, что было использовано недостаточно много воды или сырье было не совсем качественным
Итак, как приготовить раствор для тротуарной плитки?
Должны применяться определенные способы работы с бетоном – тогда тротуарная плитка получится крепкой, качественной. Ее можно будет использовать в любых местах – выложить красивую дорожку, украсить детскую площадку или приусадебный участок. Возможно, для кого-то попытка создать домашнюю плитку станет способом начать собственный бизнес.
Ее можно будет использовать в любых местах – выложить красивую дорожку, украсить детскую площадку или приусадебный участок. Возможно, для кого-то попытка создать домашнюю плитку станет способом начать собственный бизнес.
Задание Анастасии «Мастер по ремонту квартир»
от 4 000 ₽
Спасибо Олегу за отлично выполненную работу, прошло около недели после завершения, все отлично держится, ни малейших нареканий. Олег самостоятельно закупил черновые материалы, что существенно ускорили работы, за это отдельный респект. Разумный срок, высокое качество, цена средняя или чуть выше среднего, но стоит того. Отличный мастер.
Исполнитель задания:
Олег
4,9 211 отзывов
Создать такое же задание
всё про ремонт и обустройство жилья
Если на этой странице вам непонятно – сделали ещё более упрощённый вариант объяснения – перейти…
Но если и там вам будет сложно – тогда мы бессильны.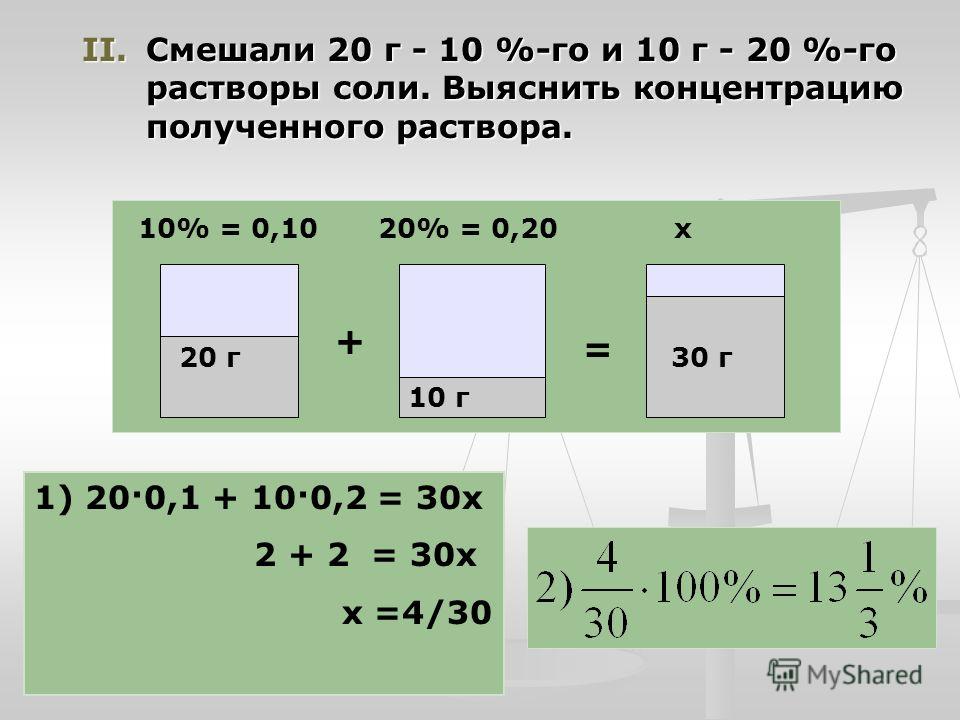
Большинство реактивов, которые продаются в химических магазинах, находятся в сухом виде. Однако используются они обычно в виде растворов. Поэтому один из самых частых вопросов от наших покупателей – как из сухого вещества сделать раствор нужной концентрации.
Напоминаем, что все работы с химическими веществами следует проводить с соблюдением необходимых мер безопасности! Используйте средства индивидуальной защиты органов дыхания, глаз и кожных покровов!
В зависимости от способа и методики приготовления растворы можно разделить на приблизительные и точные. Вторые можно приготовить только в лабораторных условиях с использованием дорогостоящего оборудования и посуды.
С другой стороны, “точности” приблизительных растворов вполне достаточно для проведения домашних опытов, удаления ржавчины или загрязнения, очистки или обеззараживания воды в аквариуме или в бассейне, для таких хобби, как химическая металлизация, печать фотографий, выращивание кристаллов, изготовления мыла и свечей и многих других.
Растворение химических веществ может производится в разных средах – воде, спирте, кислотах и т.д. В этой статье мы будем говорить только о растворении в воде.
Что такое концентрация раствора?Концентрацию раствора выражают в процентах, например 10% раствор или 0,5% раствор. Эта цифра показывает, сколько частей вещества приходится на 100 частей раствора.
Так, в 100 граммах 10%-го раствора поваренной соли находится 10 грамм соли и 90 грамм воды. А в 500 граммах 30%-го раствора гидроксида натрия содержится 150 грамм NaOH и 350 грамм воды. Один килограмм 0,2%-го раствора нитрата серебра состоит из 2 грамм нитрата серебра и 998 грамм воды.
Отметим, что существует разница между массовой концентрацией и объемной концентрацией растворов, и эта разница тем больше, чем больше концентрация растворенного вещества и плотность раствора.
Например, чтобы приготовить 1 килограмм 15%-го раствора NaCl нужно смешать 150 грамм соли и 850 грамм воды. Для приготовления же 1 литра 15%-го раствора NaCl понадобится уже 166,2 грамм NaCl и 941,8 грамм воды (при растворении соли в воде объём раствора несколько увеличится), и плотность увеличится с 1,000 (на самом деле 0,998) до 1,108.
Для приготовления же 1 литра 15%-го раствора NaCl понадобится уже 166,2 грамм NaCl и 941,8 грамм воды (при растворении соли в воде объём раствора несколько увеличится), и плотность увеличится с 1,000 (на самом деле 0,998) до 1,108.
Объясняется такая разница тем, что плотность солевого раствора выше, чем плотность чистой воды.
В этой статье, для упрощения, речь всегда будет идти о массовой концентрации раствора, то есть вес раствора будем измерять в граммах, а не в миллилитрах.
Приготовление водного раствора из сухого безводного реактиваПрежде всего, определитесь – какой вес раствора вам понадобится. Если раствор этого вещества нестабилен или он вам нужен для какой-то разовой работы – готовьте столько раствора, сколько нужно сейчас. Если же раствор хорошо хранится и используется время от времени, можно приготовить его с запасом.
Теперь рассчитаем количество вещества, которое нужно взять для приготовления определенной массы раствора определённой концентрации:
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Соответственно, масса воды вычисляется как разница между общей массой раствора и массой сухого вещества.
Пример 1: приготовим 5%-й раствор гидроксида натрия (NaOH) массой 500 грамм.
Масса NaOH = (5) * (500 гр/100) = 25 грамм.
Масса воды = 475 грамм.
Пример 2: приготовим 37%-й раствор аммония фосфорнокислого (NH4H2PO4) массой 750 грамм.
Масса (NH4H2PO4) = (37) * (750 гр/100) = 277,5 грмм.
Масса воды = 472,5 грамм.
Остаётся растворить навеску сухого реактива в рассчитанном объёме воды.
Приготовление раствора из водных солей (кристаллогидратов)Если вам нужно приготовить раствор из вещества, содержащего кристаллизационную воду (например, медный купорос CuSO4*5H2O, хромокалиевые квасцы KCr(SO4)2*12H2O и тому подобные вещества), то методика расчетов меняется, чтобы учесть уже имеющуюся в веществе воду.
Опять же, начинаем с определения массы раствора, который мы хотим приготовить. Затем вычисляем, сколько вещества должно содержаться в растворе такой массы нужной нам концентрации – формула та же, что и при использовании безводных реактивов.
Затем вычисляем, сколько вещества должно содержаться в растворе такой массы нужной нам концентрации – формула та же, что и при использовании безводных реактивов.
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Далее, пересчитываем массу вещества на кристаллогидрат. Для этого в справочниках (Яндекс или Google – наше всё) находим молярные массы безводной формы этого вещества и кристаллогидрата и вычисляем соотношение – сколько вещества в безводной форме содержится в кристаллогидрате. Так, если молярная масса кристаллогидрата 150 грамм/моль, а безводная форма этого вещества имеет молярную массу 70 грамм/моль, это значит, что в 150 грамм кристаллогидрата содержатся 70 грамм безводной формы вещества.
Определив, какое количество кристаллогидрата вещества нам нужно растворить, вычисляем необходимую массу воды.
Пример 1. Приготовим 500 грамм 15%-го раствора карбоната натрия 10-водного Na2CO3∙ 10H2O
Определяем массу карбоната натрия в 500 граммах 15%-го раствора:
Na2CO3 = (15) * (500 гр/100) = 75 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса Na2CO3 = 106 грамм/моль, молярная масса Na2CO3∙ 10H2O = 286 грамм/моль. Таким образом, 286 грамм карбоната натрия 10-водного содержат 106 грамм карбоната натрия безводного.
Молярная масса Na2CO3 = 106 грамм/моль, молярная масса Na2CO3∙ 10H2O = 286 грамм/моль. Таким образом, 286 грамм карбоната натрия 10-водного содержат 106 грамм карбоната натрия безводного.
Нам нужно, чтобы в растворе оказалось 75 грамм карбоната натрия безводного. Составляем пропорцию и получаем, что нужно взять 202 грамма карбоната натрия 10-водного.
Последний шаг – посчитать нужное количество воды. 500 грамм минус 202 грамма = 298 грамм воды.
Пример 2. Приготовим 1000 грамм 3%-го раствора сульфата магния 7-водного MgSO 4 ∙ 7H2O
Определяем массу сульфата магния в 1000 граммах 3%-го раствора:
MgSO4 = (3) * (1000 гр/100) = 30 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса (MgSO4) = 120 грамм/моль, молярная масса (MgSO4∙ 7H2O) = 246 грамм/моль.
Вычисляем, что для того, чтобы получить в растворе 30 грамм сульфата магния нужно взять 62 грамма сульфата магния 7-водного.
Смешиваем 938 грамм воды и 62 грамма сульфата магния 7-водного, получаем нужный результат.
Получайте на почту один раз в сутки одну самую читаемую статью. Присоединяйтесь к нам в Facebook и ВКонтакте.
1. Что необходимо добавить в раствор
Приблизительно четверть века назад купить качественный цемент или готовый к применению клей было достаточно проблематично. Чтобы улучшить свойства раствора, наш народ додумался добавлять в него ПВА. Смесь использовалась при проведении любых строительных работ, в том числе при штукатурке стен и заливке полов. Клей обеспечивает раствору повышенные показатели цепкости и эластичности.
Но здесь нужно знать одну маленькую хитрость. Не все разновидности клея можно добавлять в цементный раствор. Для получения максимального эффекта рекомендуется брать ПВА-МБ. В составе этого клея присутствует поливинилацетат. Этот полимер обладает высокими показателями адгезии к всевозможным поверхностям и способен выдержать как низкие, так и высокие температуры.
2. Сколько клея понадобится
При приготовлении такого комбинированного раствора следует понимать, сколько клея требуется добавить. Прежде всего, необходимо учитывать, для чего именно этот раствор будет применяться.
- Для укладки плитки требуется взять цемент и песок из расчета 1:5 и добавить в смесь ПВА. Клей должен присутствовать в количестве двадцати процентов от всей массы. При условии, что раствор очень густой, можно влить немного воды.
- Для повышения эластичности и прочности бетона в смесь добавляется около пяти-десяти процентов клея.
- Если раствор готовится для заливки пола, тогда нужно взять 50 кг цемента (один мешок), два мешка по 50 кг песка и 150 кг щебня и добавить 10 кг клея. Воды потребуется меньше.
- Для ремонта стен (штукатурка сыплется) нужно взять одну часть цемента, три – песка, ½ ПВА.
- Для штукатурки стен можно воспользоваться раствором, приготовленным по описанному в первом пункте способу: на 10 кг смеси приблизительно восемьдесят граммов клея.

Срок годности такого раствора превысит все ваши ожидания. Проверено многолетним опытом.
Не менее интересно будет узнать, зачем мастера добавляют обычный сахар в цементный раствор.
Понравилась статья? Тогда поддержи нас, жми:
Приготовление титрованных растворов — Национальная сборная Worldskills Россия
“
Один из самых простых в исполнении и наиболее распространенный метод количественного химического анализа — титриметрический. Он основан на измерении объема раствора с точно известной концентрацией реактива — титрованного раствора, расходуемого для реакции с определяемым веществом. О том, как приготовить титрованный раствор, поговорим в этом уроке.
Глоссарий
Для успешного освоения материала рекомендуем вам изучить следующие понятия:
Точно измеренный объем раствора, взятый для анализа, который сохраняет свойства основного образца
Лабораторный сосуд для точного определения небольших объемов жидкостей, тонкая градуированная стеклянная трубка, открытая на одном конце и снабженная краном (стеклянным или тефлоновым) или зажимом на другом
Соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH
Метод определения кислот, оснований, солей, основанный на реакции взаимодействия между кислотой и основанием
Перенос точного количества сухого вещества или жидкости, сопровождающийся многократным ополаскиванием исходной тары
Раздел аналитической химии, в задачу которого входит определение количества элементов, функциональных групп, соединений в анализируемом объекте
Коническая колба, которую применяют при аналитических работах, в частности при титровании
Число, выражающее отношение действительной (практической) концентрации раствора к заданной (теоретической)
Нанесение условных знаков, букв, цифр, графических знаков или надписей на объект с целью его дальнейшей идентификации (узнавания), указания его свойств и характеристик
Число молей растворенного вещества в 1 литре раствора
Точно отведенное количество вещества
Метод определения окислителей или восстановителей, основанный на использовании окислительно-восстановительных реакций, протекающих между определяемым веществом и титрантом
Основано на определении конечной точки титрования (КТТ) по результатам измерения потенциала индикаторного электрода, реагирующего на изменение активности одного из участвующих в реакции веществ или продукта реакции
Соответствие техническим требованиям
Характеристика близости результатов, полученных для одного и того же образца одним и тем же методом в одних и тех же условиях (оператор, аппаратура, лаборатория) в течение короткого промежутка времени
Вещество, участвующее в химической реакции
Одна из наиболее распространенных мер центральной тенденции, представляющая собой сумму всех зафиксированных значений, деленную на их количество
Наборы химических реактивов, выпускаемые промышленностью в запаянных ампулах. Ампулы содержат точно известное количество вещества
Ампулы содержат точно известное количество вещества
Определение точной концентрации раствора
Образец вещества или материала с установленными по результатам испытаний значениями одной или более величин, характеризующих свойство или состав этого вещества или материала
Масса вещества в граммах / миллиграммах в 1 мл раствора (г/мл или мг/мл)
Отношение массы определяемого вещества к объему раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора
Метод количественного / массового анализа, который часто используется в аналитической химии, основанный на измерении объема раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом
Раствор точно известной концентрации, предназначенный для целей титриметрического анализа
Высшая степень чистоты реактива. Содержание основного компонента более 99%
Вид мерной химической посуды, предназначенной для измерения объемов жидкостей как на налив, так и для последующего выливания в другую посуду
Видеолекция
Конспект
Выражения для концентрации титрованного раствора
Молярная концентрация — количество моль растворенного вещества, содержащееся в 1 л раствора.
Титр — выраженная в миллиграммах масса растворенного вещества, содержащаяся в 1 мл раствора.
Титр по определяемому веществу — масса определяемого вещества, эквивалентная 1 мл данного титранта.
Эквивалент вещества — такое количество вещества, которое может присоединять или высвобождать один катион водорода в кислотно-основных (ионообменных) реакциях или один электрон в окислительно-восстановительных реакциях. Он определяется исходя из его химической формулы, принадлежности к тому или иному классу химических соединений, а также химической реакции протекающей между определяемым веществом и титрованным раствором.
Стандартизация титранта
Растворы стандартизируют двумя способами:
1. По стандартному титрованному раствору
2. По точной навеске соответствующего стандартного образца.
Формула расчета концентрации по стандартному титрованному раствору:
— молярная концентрация эквивалента стандартного раствора, моль/л
— молярная концентрация эквивалента титранта, моль/л
— аликвотная часть стандартного раствора, взятого на анализ, мл
— объем титранта, израсходованный на титрование, мл
Формула расчета концентрации по навеске:
— молярная концентрация эквивалента титранта, моль/л
— масса навески установочного вещества, г
— молярная масса эквивалента определяемого вещества, г/моль
— объем титранта, израсходованный на титрование, мл
Установление коэффициента поправки
- Использовать не менее 3 навесок установочного вещества или разных объемов раствора установочного вещества.

- Устанавливать коэффициент тем методом, которым будет проводиться количественный анализ.
- Состав среды, в которой стандартизируется титрованный раствор, должен быть таким же, как и тот, в котором он будет использован.
- Перед стандартизацией титрованный раствор необходимо тщательно перемешать.
- По итогам как минимум 3 титрований должны получиться коэффициенты поправки с относительным расхождением не более 0,2% и средний арифметический результат в промежутке от 0,98 до 1,02.
Приготовление 1М раствора соляной кислоты
Что нам понадобится
Инструменты и посуда
Мерная колба
Воронка
Пипетка Мора
Капельная пипетка
Мерный стакан
Резиновая груша
Стакан для слива
Реактивы
Концентрированная соляная кислота
Очищенная вода
Концентрированная соляная кислота
Очищенная вода
Этапы работы
1. Заполнить колбу на ⅓ объема водой.
Заполнить колбу на ⅓ объема водой.
2. Промыть пипетку, используя промежуточный промаркированный стакан с концентрированной кислотой и слив.
3. Отобрать 8,7 мл концентрированной соляной кислоты и перенести аликвоту в мерную колбу.
4. Перемешать раствор.
5. Проверить температуру.
6. Раствор комнатной температуры довести водой до метки.
7. Перемешать еще раз раствор.
Установка приготовленного раствора по карбонату натрия
Что нам понадобится
Инструменты и посуда
3 конические колбы на 250 мл
Цилиндр на 50 мл
Бюретка на 25 мл
Штатив с лапкой
Нагреватель
Стакан для слива
3 бюкса
Реактивы
Раствор индикатора метилового оранжевого
3 навески карбоната натрия
Очищенная вода
Этапы работы
1. Перенести и растворить навеску карбоната натрия в 50 мл воды очищенной.
Перенести и растворить навеску карбоната натрия в 50 мл воды очищенной.
2. Добавить 2−3 капли раствора индикатора.
3. Титровать до красно-желтого оттенка раствора.
4. Зафиксировать объем титрованного раствора, который пошел на титрование. Повторить определение еще 2 раза.
5. Рассчитать коэффициент поправки по формуле:
6. Проверить приемлемость каждого из коэффициентов.
Сходимость:
Среднее арифметическое:
Маркировка растворов
На емкости с титрованным раствором должна содержаться следующая информация:
- Формула растворенного вещества
- Концентрация растворенного вещества
- Установленный коэффициент поправки
- Дата приготовления и установки коэффициента
- Индикатор, с которым устанавливался коэффициент
- Температура приготовления раствора
- ФИО готовившего
“
Вы узнали, как приготовить титрованный раствор. Закрепите новые знания с помощью тестов и интерактивных заданий.
Закрепите новые знания с помощью тестов и интерактивных заданий.
Интерактивное задание
Для закрепления полученных знаний пройдите тест
| Стартуем! |
Титр раствора
Титр раствора по определяемому веществу
Массовая доля
Молярная концентрация эквивалента
| Дальше |
| Проверить |
| Узнать результат |
0,98–1,03
0,96–1,02
0,97–1,05
0,98–1,02
| Дальше |
| Проверить |
| Узнать результат |
Молярная концентрация
Титр по определяемому веществу
Эквивалент вещества
Аликвота
| Дальше |
| Проверить |
| Узнать результат |
К сожалению, вы ответили неправильно
Прочитайте лекцию и посмотрите видео еще раз
| Пройти еще раз |
Неплохо!
Но можно лучше. Прочитайте лекцию и посмотрите видео еще раз
Прочитайте лекцию и посмотрите видео еще раз
| Пройти еще раз |
Отлично!
Вы отлично справились. Теперь можете ознакомиться с другими компетенциями
| Пройти еще раз |
Приготовление растворов | это… Что такое Приготовление растворов?
13.3.2 Приготовление растворов
13.3.2.1 Приготовление 5 % (v/v) раствора азотной кислоты
См. п. 10.3.2.1.
13.3.2.2 Приготовление 1 % (v/v) раствора азотной кислоты
В мерной колбе вместимостью 1 дм3 к небольшому количеству бидистиллированной воды прибавляют 10 см3 концентрированной азотной кислоты, доводят объем до метки бидистиллированной водой и тщательно перемешивают. Срок хранения раствора – 3 месяца при комнатной температуре.
13.3.2.3 Приготовление ~0,1 моль/дм3 раствора соляной кислоты
В мерной колбе вместимостью 1 дм3 к небольшому количеству бидистиллированной воды прибавляют 8 см3 концентрированной соляной кислоты, доводят объем до метки бидистиллированной водой и тщательно перемешивают.
При использовании фиксаналов соляной кислоты содержимое ампулы количественно переносят в мерную колбу вместимостью 1 дм3, доводят до метки бидистиллированной водой и тщательно перемешивают.
Срок хранения раствора – 3 месяца при комнатной температуре.
13.3.2.4 Приготовление раствора хлористого лантана (спектроскопического буфера для измерения концентрации кальция, магния и стронция)
25 г хлористого лантана (LaCl3×7H2O) растворяют в 50 – 60 см3 0,1 моль/дм3 раствора НСl, переносят в мерную колбу вместимостью 100 см3, доводят до метки 0,1 моль/дм3 раствором HCl.
В закрытом стеклянном сосуде раствор устойчив в течение 3 месяцев при комнатной температуре.
13.3.2.5 Приготовление градуировочных растворов кальция
10 см3 раствора кальция (ГСО, 1 мг/см3) с помощью пипетки переносят в мерную колбу вместимостью 100 см3. Доводят объем до метки 1 % (v/v) раствором азотной кислоты и перемешивают. Полученный основной градуировочный раствор содержит 100 мг/дм3 кальция. Срок хранения раствора – 2 месяца при температуре (2 – 10) °С.
Доводят объем до метки 1 % (v/v) раствором азотной кислоты и перемешивают. Полученный основной градуировочный раствор содержит 100 мг/дм3 кальция. Срок хранения раствора – 2 месяца при температуре (2 – 10) °С.
5 см3 основного градуировочного раствора с помощью пипетки переносят в мерную колбу вместимостью 50 см3 и доводят объем до метки 1 % (v/v) раствором азотной кислоты. Концентрация кальция в полученном рабочем растворе – 10 мг/дм3. Срок хранения раствора – 1 месяц при температуре (2 – 10) °С.
Градуировочные растворы кальция готовят в соответствии с таблицей 8, добавляя в мерные колбы вместимостью 50 см3 по 5 см3 раствора соли лантана перед доведением объема до метки 1 % (v/v) раствором азотной кислоты (в том числе для «холостого» раствора). Срок хранения растворов – 1 месяц при температуре (2 – 10) °С или 14 дней при комнатной температуре.
13.3. 2.6 Приготовление градуировочных растворов магния
2.6 Приготовление градуировочных растворов магния
1 см3 раствора магния (ГСО, 1 мг/см3) с помощью пипетки переносят в мерную колбу вместимостью 100 см3. Доводят объем до метки 1 % (v/v) раствором азотной кислоты и перемешивают. Полученный основной градуировочный раствор содержит 10 мг/дм3 магния. Срок хранения раствора – 1 месяц при температуре (2 – 10) °С.
5 см3 основного градуировочного раствора с помощью пипетки переносят в мерную колбу вместимостью 50 см3 и доводят объем до метки 1 % (v/v) раствором азотной кислоты. Концентрация магния в полученном рабочем растворе 1 мг/дм3. Срок хранения раствора – 1 месяц при температуре (2 – 10) °С.
Градуировочные растворы магния готовят в соответствии с таблицей 9, добавляя в мерные колбы вместимостью 50 см3 по 5 см3 раствора соли лантана перед доведением объема до метки 1 % (v/v) раствором азотной кислоты (в том числе для «холостого» раствора). Срок хранения растворов – 1 месяц при температуре (2 – 10) °С или 14 дней при комнатной температуре.
Срок хранения растворов – 1 месяц при температуре (2 – 10) °С или 14 дней при комнатной температуре.
Источник: ПНД Ф 16.2.2:2.3.71-2011: Количественный химический анализ почв. Методика измерений массовых долей металлов в осадках сточных вод, донных отложениях, образцах растительного происхождения спектральными методами
Смотри также родственные термины:
5.5 Приготовление растворов ионов бората
5.5.1 Приготовление раствора ионов бората массовой концентрации 200 мг/дм3
Для приготовления раствора в мерную колбу вместимостью 25 см3 помещают 5 см3 ГСО состава раствора ионов бората массовой концентрации 1 мг/см3 и доводят до метки дистиллированной водой. Концентрация бора в данном растворе составляет 36,7 мг/дм3.
Раствор пригоден для использования в течение двух недель при хранении в емкости из полиэтилена в нормальных климатических условиях.
5.5.2 Приготовление раствора ионов бората массовой концентрации 20 мг/дм3
Для приготовления раствора в мерную колбу вместимостью 50 см3 помещают 5 см3 раствора бората концентрации 200 мг/дм3 по 5. 5.1 и доводят дистиллированной водой до метки. Концентрация бора в данном растворе составляет 3,67 мг/дм3.
5.1 и доводят дистиллированной водой до метки. Концентрация бора в данном растворе составляет 3,67 мг/дм3.
Раствор пригоден для использования в течение одной недели при хранении в емкости из полиэтилена в нормальных климатических условиях.
Определения термина из разных документов: Приготовление растворов ионов бората
Источник: ГОСТ Р 51210-98: Вода питьевая. Метод определения содержания бора оригинал документа
3.6. Приготовление растворов сравнения
3.6.1. Приготовление исходного раствора с массовой концентрацией аммонийного азота 0,5 г/дм3
(1,910 ± 0,001) г хлористого аммония, высушенного до постоянной массы при температуре 105 °С, помещают в мерную колбу вместимостью 1000 см3 и растворяют в воде, доводя объем до метки.
Раствор хранят в холодильнике не более 1 мес.
3.6.2. Приготовление серии растворов сравнения
Серию растворов сравнения готовят по ГОСТ 27753.0. Объемы исходного раствора, необходимые для приготовления серии растворов сравнения, указаны в таблице.
Характеристика раствора | Номер раствора сравнения | |||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
Объем исходного раствора, см3 | 0 | 0,5 | 0,1 | 1,5 | 2,0 | 3,0 | 4,0 | 5,0 |
Массовая концентрация аммонийного азота в растворе сравнения, г/дм3 | 0 | 0,0025 | 0,005 | 0,0075 | 0,010 | 0,015 | 0,020 | 0,025 |
В пересчете в массовую долю аммонийного азота в грунте, млн-1 (мг/кг): | ||||||||
при отношении грунта и воды 1:5 | 0 | 12,5 | 25,0 | 37,5 | 50,0 | 75,0 | 100 | 125 |
при отношении грунта и воды 1:10 | 0 | 25 | 50 | 75 | 100 | 150 | 200 | 250 |
Определения термина из разных документов: Приготовление растворов сравнения
Источник: ГОСТ 27753. 8-88: Грунты тепличные. Метод определения аммонийного азота оригинал документа
8-88: Грунты тепличные. Метод определения аммонийного азота оригинал документа
3.8. Приготовление растворов сравнения
В мерные колбы вместимостью 250 см3 помещают указанные в таблице объемы раствора, приготовленного по п. 3.7, и доводят объемы до меток раствором хлористого калия концентрации 1 моль/дм3.
Характеристика раствора | Номер раствора сравнения | |||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
Объем раствора, приготовленного по п. 3.7, см3 | 0 | 2 | 4 | 8 | 12 | 16 | 20 | 24 |
Концентрация азота нитратов: | ||||||||
в растворе сравнения, мг/дм3 | 0 | 1 | 2 | 4 | 6 | 8 | 10 | 12 |
в пересчете на массовую долю в почве, млн-1 | 0 | 2,5 | 5,0 | 10 | 15 | 20 | 25 | 30 |
Растворы сравнения используют для градуировки фотоэлектроколориметра вдень проведения анализа. Окрашивание растворов сравнения проводят аналогично окрашиванию анализируемых вытяжек и одновременно с ними.
Окрашивание растворов сравнения проводят аналогично окрашиванию анализируемых вытяжек и одновременно с ними.
Определения термина из разных документов: Приготовление растворов сравнения
Источник: ГОСТ 26488-85: Почвы. Определение нитратов по методу ЦИНАО оригинал документа
3.7. Приготовление растворов сравнения
В мерные колбы вместимостью 250 см3 помещают указанные в таблице объемы раствора, приготовленного по п. 3.6, и доводят объемы до меток раствором хлористого калия концентрации 1 моль/дм3.
Характеристика раствора | Номер раствора сравнения | |||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
Объем раствора, приготовленного по п. | 0 | 2 | 4 | 8 | 12 | 16 | 20 | 24 |
Концентрация азота аммония: | ||||||||
в растворе сравнения, мг/дм3 | 0 | 2 | 4 | 8 | 12 | 16 | 20 | 24 |
в пересчете на массовую долю в почве, млн-1 | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 |
Растворы сравнения используют для градуировки фотоэлектроколориметра в день проведения анализа. Окрашивание растворов сравнения проводят аналогично окрашиванию анализируемых вытяжек и одновременно с ними.
Окрашивание растворов сравнения проводят аналогично окрашиванию анализируемых вытяжек и одновременно с ними.
Определения термина из разных документов: Приготовление растворов сравнения
Источник: ГОСТ 26489-85: Почвы. Определение обменного аммония по методу ЦИНАО оригинал документа
3.3. Приготовление растворов сравнения
В мерные колбы вместимостью 250 см3 помещают указанные в таблице объемы раствора, приготовленного по п. 3.2. Объемы растворов доводят до метки раствором хлористого калия концентрации 1 моль/дм3 и тщательно перемешивают.
Характеристика раствора | Номер раствора сравнения | |||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
Объем раствора, приготовленного по п. | 0 | 2 | 4 | 8 | 12 | 16 | 20 | 24 |
Концентрация серы: | ||||||||
в растворе сравнения, мг/дм3 | 0 | 0,8 | 1,6 | 3,2 | 4,8 | 6,4 | 8,0 | 9,6 |
в пересчете на массовую долю в почве, млн-1 | 0 | 2 | 4 | 8 | 12 | 16 | 20 | 24 |
Растворы хранят в склянках с притертыми пробками не более 1 мес.
Растворы сравнения используют для градуировки фотоэлектроколориметра в день проведения анализа.
Определения термина из разных документов: Приготовление растворов сравнения
Источник: ГОСТ 26490-85: Почвы. Определение подвижной серы по методу ЦИНАО оригинал документа
3.8. Приготовление растворов сравнения
В мерные колбы вместимостью 250 см3 помещают указанные в таблице объемыраствора, приготовленного по п. 3.7. Объемы растворов в колбах доводят до метки раствором хлористого калия концентрации 1 моль/дм3.
Характеристика раствора | Номер раствора сравнения | |||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
Объем раствора, приготовленного по п. | 0 | 2 | 4 | 8 | 12 | 16 | 20 | 24 |
Концентрация алюминия с (1/3Аl3+): | ||||||||
в растворе сравнения, ммоль/дм3 | 0 | 0,2 | 0,4 | 0,8 | 1,2 | 1,6 | 2,0 | 2,4 |
в пересчете на 100 г почвы, ммоль | 0 | 0,05 | 0,10 | 0,20 | 0,30 | 0,40 | 0,50 | 0,6 |
Растворы хранят в склянках с притертыми пробками не более 3 мес.
Растворы сравнения используют для градуировки фотоэлектроколориметра в день проведения анализа. Окрашивание растворов сравнения проводят аналогично окрашиванию анализируемых вытяжек и одновременно с ними.
Определения термина из разных документов: Приготовление растворов сравнения
Источник: ГОСТ 26485-85: Почвы. Определение обменного (подвижного) алюминия по методу ЦИНАО оригинал документа
Словарь-справочник терминов нормативно-технической документации. academic.ru. 2015.
Как приготовить раствор для кладки кирпича
Здания из кирпича славятся своей прочностью, их стены имеют отличную звуконепроницаемость и долго не теряют тепло внутри помещений. Возведение кирпичных зданий, промышленных или жилых, требует средств, времени, а также сил, если строительство ведется самостоятельно. Очень важно приготовить правильный раствор для кирпичной кладки, чтобы сооружение получилось крепким, прочным и прослужило не одно десятилетие.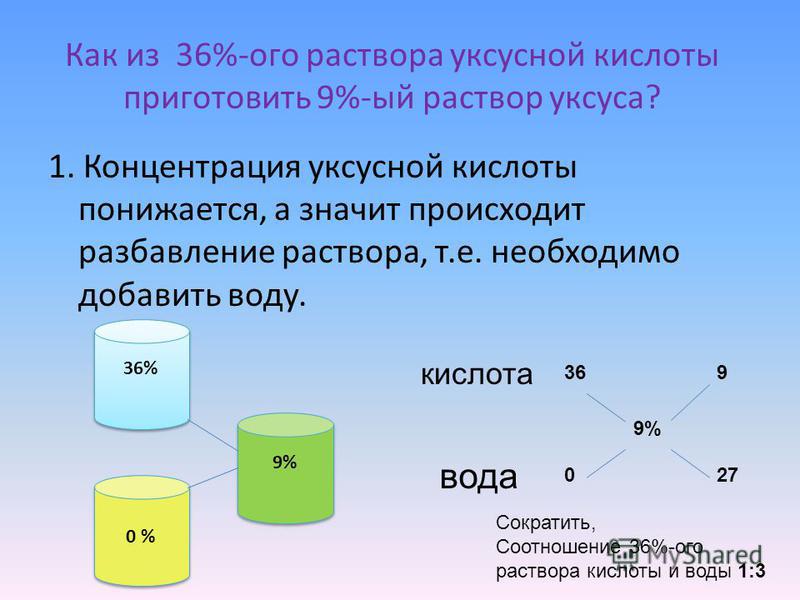
КУПИТЬ КЛАДОЧНУЮ СМЕСЬ
Требования к кладочному раствору
Правильно приготовленный кладочный раствор невероятно важен для строительства. Основные требования к нему таковы:
- Прочность
- Хорошая адгезия
- Удобство в использовании
- Изоляционные свойства
Так, например, раствор для кирпичной кладки должен быть прочным, чтобы стены, перегородки, печи и другие сооружения выдерживали натиск внешних факторов. Не менее важна качественная адгезия – способность “скрепляться” с поверхностью кирпичей. Это также важно для надежности конструкции. Кладочная смесь должна способствовать качественной звуко- и теплоизоляции, придавать влагостойкость.
По-прежнему одним из важнейших требований к любому раствору для кирпича – пластичность разбавленной смеси. Добиться оптимального результата можно с помощью пластификаторов в жидком виде.![]()
Из кирпича возводят не только дома, но и печи и камины. В таком случае раствор должен иметь не только прочность, подвижность и хорошее сцепление с кирпичом, но и огнеупорность. Очень часто для такой смеси используют глину.
Классификация кладочных растворов
Понимание того, как классифицируются растворы для кирпичной кладки, поможет выбрать подходящую смесь. Делятся составы по вяжущему веществу. Можно выделить несколько типов:
- Цементный
- Известковый
- Известково-цементный
- Цементно-глиняный
- Глиняный
Каждый из них имеет свои преимущества и недостатки.
Цементный раствор используется для кирпичной кладки чаще всего. Он очень прочен и долговечен, славится высокой адгезией. Цемент подходит для строительства и жилых, и коммерческих зданий с разным количеством этажей. Также цементный раствор используют при возведении блочных и кирпичных фундаментов.
Цементный растворК минусам данного материала можно отнести способность впитывать влагу, что существенно снижает его морозостойкость, а также тяжесть готового раствора. Также цементная смесь для кладки долго застывает.
Также цементная смесь для кладки долго застывает.
Известковый раствор – это пластичный, безопасный и довольно легкий материал. Он удобен в работе, обладает неплохими теплоизоляционными свойствами, безопасен для человека. Однако используют известковый раствор для кирпичной кладки нечасто и преимущественно для малоэтажных строений, так как высокой прочностью он похвастаться не может. Кроме того, он долго сохнет и “боится” влаги.
При этом неплохим вариантом является цементно-известковый раствор, который совмещает в себе и прочность цемента, и мягкость извести. Он пластичен, удобен в работе, в меру тяжел и прекрасно подходит как для сухих, так и для влажных помещений. Так как цементно-известковый раствор способен выдержать немало нагрузки, он подходит для несущих конструкций, и для многоэтажных зданий.
Цементно-глиняный раствор по своим свойствам напоминает цементно-известковый аналог. Он не “боится” температурных перепадов, надежен и быстрее сохнет, поэтому также используется в строительстве.
Глиняный раствор из-за специфики основного компонента – глины – подготовить сложнее, чем цементный вариант. Ее не используют для тяжелых зданий и фундаментов, но применяют для возведения каминов и печей.
Глина может быть жирной, тощей или нормальной. Оптимальным вариантом будет именно нормальная глина – после высыхания такой раствор не потрескается, при этом он удобен в работе. Жирная глина, несмотря на свою пластичность, может покрыться трещинами после застывания. А тощая глина не только неудобна в нанесении, но и не слишком прочна, поэтому ее не стоит использовать в качестве основного компонента.
Приготовление глиняного раствора для кладкиКлассификация растворов по сложности приготовления
По типу сложности растворы для кирпичной кладки делятся на простые и сложные. В первом случае подразумеваются смеси из песка и одного вяжущего компонента. Например, простым будет раствор, состоящий из цемента и песка. К такому же виду относится известково-песчаный состав.
Сложные растворы – это те, в чей состав входит более одного вяжущего компонента. Вышеупомянутый цементно-известковый раствор будет именно сложным. К данному типу относится также глиняно-известковая смесь.
Жирные, нормальные и тощие растворы
Не только глина может быть жирной, тощей или нормальной. Готовый раствор тоже может быть как чрезмерно пластичным, жирным, так как в него добавили много вяжущего вещества, так и тощим, то есть, обделенным основным компонентом. Оба варианта допустимы в отдельных случаях, но их нельзя использовать для частного домостроения.
Так, например, жирный раствор для кладки имеет высокую усадку, он склонен к растрескиванию после застывания, хотя в работе довольно удобен благодаря своей пластичности. А тощий раствор можно назвать бюджетным вариантом, но работать с ним сложнее, а в готовом виде он не отличается прочностью.
Важно! Растворы для кирпичной кладки также делятся по весу:
- Легкие – до 1500 кг/м³
- Тяжелые – от 1500 кг/м³
Правила приготовления растворов
Первое, на что стоит обратить внимание во время приготовления раствора для кирпичной кладки, – пропорция. Благодаря правильно подобранной пропорции можно получить качественный раствор. На ее расчет влияют следующие факторы:
Благодаря правильно подобранной пропорции можно получить качественный раствор. На ее расчет влияют следующие факторы:
- Тип грунта на площадке, где ведется строительство
- Тип объекта, для которого нужен раствор
- Количество этажей
Когда речь идет о цементно-песчаной смеси, используют, как правило, пропорцию 1:3 – она универсальна и обеспечивает высокую прочность раствора. Но если предполагается нагрузка поменьше, пропорцию можно увеличить вплоть до 1:6. Кроме того, обратить внимание стоит также на марку цемента – чем она выше, тем больше может быть соотношение компонентов.
С известковым раствором пропорции схожи. Допустимо соотношение от 1:2 до 1:5. Универсальным считается пропорция 1:4 – 1 часть извести и 4 части песка.
ВАЖНО! Известь должна быть гашеной. Использование негашеной извести недопустимо. В продаже она встречается как готовой к использованию, так и негашеной. Процедура гашения займет немало времени перед тем, как можно будет приступать к приготовлению раствора, но этот этап обязателен. При этом необходимы средства защиты: перчатки, респираторы и другие. Во время гашения извести выделяются вредные для человека вещества.
При этом необходимы средства защиты: перчатки, респираторы и другие. Во время гашения извести выделяются вредные для человека вещества.
Цементно-известковая смесь имеет два самых частых сочетания:
- 1 часть цемента, 1 часть извести, 6 частей песка
- 1 часть цемента, 1 часть извести, 15 частей песка
Глиняный раствор для кладки подразумевает пропорцию либо 1:1, либо 1:2. Желательно смотреть на густоту и вязкость раствора, чтобы он не получился слишком жидким или слишком твердым.
Каким должен быть песок для кладочного раствора?
К песку также имеются требования. Самым желаемым вариантом будет речной кварцевый песок – в нем, как правило, нет лишних примесей и глины, он прекрасно смешивается с вяжущими компонентами и позволяет получить прочный, в меру вязкий и хороший по качеству раствор для кладки. Именно от песка зависит объем готового состава, а также его будущая усадка.
Стоит с осторожностью использовать овражный песок. У него оптимальная фракция (1,5-3 мм), а благодаря шероховатости частиц он способствует хорошему сцеплению. Но из-за сильной загрязненности овражный песок применяют преимущественно для фундаментов, а также черновых кладок.
У него оптимальная фракция (1,5-3 мм), а благодаря шероховатости частиц он способствует хорошему сцеплению. Но из-за сильной загрязненности овражный песок применяют преимущественно для фундаментов, а также черновых кладок.
Существует также карьерный песок, имеющий в своем составе существенный процент глины. Из-за этого лучше не использовать его для кладочных растворов в чистом виде. Только после тщательной промывки и очистки карьерный песок становится пригодным к работе в качестве компонента для раствора.
Хорошим вариантом для кладочного раствора будет намывной песок – материал, прошедший качественную обработку водой. Технология добычи и последующие очистки позволяют получить прекрасный компонент для кладочного раствора: песок однороден (фракция – около 2 мм), лишен иглистых примесей и имеет красивый желтоватый цвет.
Песок должен быть однородным и чистымМарки растворов для кладки
Маркировка растворов используется для обозначения нагрузки, которую может выдержать кладочный раствор, или его прочности. Например, раствор марки М25 выдерживает 25 кг/см².
Например, раствор марки М25 выдерживает 25 кг/см².
Самыми распространенными марками растворов для кладки кирпича являются М4, М10, М25, М50 и М75 – чем больше число, тем, соответственно, прочнее состав. Есть также растворы с показателями от М100 до М200.
От М25 до М50 – для малоэтажных построек
От М75 до М100 – универсальный вариант, подходящий для большинства случаев
От М150 – специальные составы, используемые для фундамента в подвижном грунте, многоэтажных сооружений и так далее.
Может показаться, что при самостоятельном приготовлении рассчитать показатель прочности готового раствора не так-то просто. Ведь марка используемого цемента, если речь идет о цементном составе, и марка раствора – разные показатели. Для удобства можно использовать таблицу, где выделены как марки компонентов и раствора, так и подходящее соотношение материалов.
| Марка раствора | Марка цемента | Пропорции сухих компонентов (цемент:песок) |
| 25 | 300 | 1:9,5 |
| 50 | 300 | 1:5,8 |
| 50 | 400 | 1:7,4 |
| 75 | 300 | 1:4,2 |
| 75 | 400 | 1:5,4 |
| 75 | 500 | 1:6,7 |
| 100 | 300 | 1:3,4 |
| 100 | 400 | 1:4,3 |
| 100 | 500 | 1:5,3 |
| 150 | 300 | 1:2,6 |
| 150 | 400 | 1:3,25 |
| 150 | 500 | 1:3,9 |
Что пригодится для приготовления кладочного раствора?
- Чистая емкость для приготовления раствора – глубокое корыто или таз
- Строительный миксер – если нет возможности приобрести, можно обойтись лопатой (если объем работ не слишком большой)
- Отдельные емкости для компонентов раствора и воды – ведра, тазики
- Весы
Как приготовить раствор для кирпичной кладки
Все компоненты необходимо подготовить заранее: песок очистить, известь погасить, емкости промыть и высушить. Вяжущее вещество должно быть сухим и просеянным – так его будет легче замешать. Если в цемент, глину или известь попадет влага, образуются комочки, которые помешают получить однородный кладочный раствор.
Вяжущее вещество должно быть сухим и просеянным – так его будет легче замешать. Если в цемент, глину или известь попадет влага, образуются комочки, которые помешают получить однородный кладочный раствор.
Сначала все замешиваются сухие составляющие, а потом понемногу добавляется вода температурой от 15 до 25 °С.
Раствор желательно использовать быстро, в течение часа, пока он не начал схватываться прямо в емкости. Лучше готовить его понемногу, чем потом выбрасывать остатки, затвердевшие в корыте.
Советы по приготовлению раствора
- Существуют различные добавки, придающие готовому раствору повышенную морозо- или влагостойкость, прочность или цепкость. Они могут быть как магазинными, так и “народными” – например, обычный клей ПВА улучшает адгезию.
- Желательно, чтобы марки цемента (не раствора!) и кирпича совпадали.
- Необязательно оставлять скучный серо-бежевый оттенок кладочного раствора. В современных строительных магазинах продаются пигменты для окрашивания состава.
 Кардинально цвет не поменяется, но можно добиться интересного оттенка.
Кардинально цвет не поменяется, но можно добиться интересного оттенка. - Консистенция раствора не должна быть слишком жидкой. Она не должна стекать с кирпича, повернутого вниз на 40-45 °.
- Если используется пустотелый кирпич, расход кладочного раствора будет больше: состав будет стекать в пустоты.
Приготовление раствора для кирпичной кладки – это очень важное и ответственное дело. Однако с ним вполне можно справиться самостоятельно!
А у нас в интернет-магазине Кузьмич24 можно купить все необходимое – известь, цемент, глину и песок, а также улучшающие добавки.
Удачи в строительстве!
Ваш Кузьмич.
Глава 12.1: Подготовка растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 19928
Цель обучения
- Количественно описать концентрации растворов.

В разделе 9.3 мы описали различные способы характеристики концентрации раствора, молярности (M), моляльности (m), концентрации в процентах и мольной доли (X). Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из маточного раствора известной концентрации 9.0024
Приготовление растворов
Для приготовления раствора, содержащего указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\( Молярность раствора = dfrac{моли\: of\: solute}{Объем раствора} \tag{12.1.1}\)
На рис. 12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
12.1.1 показана эта процедура для раствора хлорида кобальта(II). дигидрат в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рис. 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок 12.1.1 Приготовление раствора известной концентрации с использованием твердого растворенного вещества 7 в воде
Растворенное вещество занимает место в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рис. 12.1.1 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (М)
Стратегия:
Чтобы найти число молей CoCl 5 2 2 900 разделить массу соединения на его молярную массу. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 ·2H 2 O составляет 165,87 г/моль. Следовательно,
\( молей\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165 ,87\: \cancel{g} /mol} \right) = 0,0603 \: моль \)
Объем раствора в литрах равен
\( объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \справа) = 0,500\: л \)
Молярность – это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\( молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \)
Упражнение
Раствор, показанный на рис. 12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
12.1.2, содержит 90,0 г ( NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1,43 M
количество молей растворенного вещества в требуемом объеме раствора с использованием соотношения, показанного в уравнении 12.1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \справа) = 27,9 \: г \: глюкоза \)
Упражнение
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор нужной концентрации можно также приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод, взвешивающий крошечные количества растворенного вещества, трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рис. 12.1.3. Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
Помните, что разбавление заданного количества исходного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0024
\((V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\tag{12.1.2}\)
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора. Рис. 12.1.3 Приготовление раствора известной концентрации путем разбавления маточного раствора0053 s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример 12.1.3
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере 4?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора
Стратегия:
A Рассчитайте количество молей разбавленного раствора глюкозы, содержащееся в нем. умножение объема раствора на его молярность.
умножение объема раствора на его молярность.
B Чтобы определить необходимый объем исходного раствора, разделите число молей глюкозы на молярность исходного раствора.
Раствор:
A Раствор D5W в примере 4 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\( моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \)
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего это количество глюкозы:
\( объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \)
При определении необходимого объема исходного раствора нам нужно было разделить желаемое количество молей глюкозы на концентрацию исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 12.1.2 для V s и подставив соответствующие значения:
\( V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2,500\: L)(0,310\: \cancel{M})} {3,00\: \cancel{M}} = 0,258\: L \)
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрация ионов в растворе
В разделе 9. 3 мы подсчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
3 мы подсчитали, что раствор, содержащий 90,00 г дихромата аммония в конечном объеме 250 мл, имеет концентрацию 1,43 М. Рассмотрим более подробно, что именно это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\tag{12.1.2} \)
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моль Cr 2 O 7 2− анионов и 2 моль катионов NH 4 + (см. рис. 12.1.4).
Рис. 12.1.4 Растворение 1 моля ионного соединения В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 дает раствор, содержащий 1 05 O 1 моль Cr 2 O 7 2− ионов и 2 моль NH 4 + ионов. (Для ясности молекулы воды опущены в молекулярном представлении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. . Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− также должно быть 1,43 М, поскольку на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует три иона при растворении в воде (2NH 4 + + 1Cr 2 O 7 2− ), общая концентрация ионов в растворе составляет 3 × 1,43 M = 4,29 M.
Пример 12.1.4
полученные из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора. 9- (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH – , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН – ] = 0,21 М.
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами.
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3,7 M. – (водн.) \)
– (водн.) \)
B One formula unit of In(NO 3 ) 3 produces one In 3 + ion and three NO 3 − ions, so a 0.032 M In(NO 3 ) 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 М = 0,096 м № 3 – – это, [в 3 + ] = 0,0323 М.0323 М.0323 M.0323. − ] = 0,096 М.
Упражнение
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [ОН – ] = 0,0024 М
- [Na + ] = 0,34 М; [ТАК 4 2− ] = 0,17 М
- [(СН 3 ) 2 СО] = 0,50 М Уравнение 12.
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- НХ 3
- ВЧ
- СН 3 СН 2 СН 2 ОН
Нет 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Нет 2 С
- Нет 3 Заказ на поставку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m . Моляльность определяется как число молей растворенного вещества в 1 кг растворителя .
 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.Каковы преимущества использования растворов для количественных расчетов?
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1,592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.

- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3,62 дигидрат йодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.

- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента потребовалось 200,0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ) растворяют в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетках некоторых лекарств есть инструкции по добавлению 10,0 мл стерильной воды с указанием, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
0,48 М ClO −
1,74 × 10 −3 М кофеин
- Анонимно
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Встроить Hypothes.
 is?
is? - да
- Лицензия
- CC BY-NC-SA
- Показать страницу TOC
- да на странице
- Этап
- Финал
- Теги
- грамма химического вещества = (молярность раствора в молях/литр) x (молекулярная масса химиката в г/моль) x (мл раствора) ÷ 1000 мл/литр
- грамма CaCl 2 = (0,1) x (110,91 ) х (100) ÷ (1000) = 1,11 г
- Рассчитайте массу растворенного вещества, необходимого для приготовления 100 мл раствора, используя приведенную выше формулу.
- Взвесьте необходимое количество растворенного вещества с помощью весов.
- Перенесите растворенное вещество в чистую сухую мерную колбу на 100 мл.
- Медленно добавьте дистиллированную воду в мерную колбу. При этом вымойте все растворенное вещество на дно колбы. Продолжайте добавлять воду, пока не достигнете отметки 100 мл на горлышке колбы.
- Поместите пробку в колбу и осторожно вращайте колбу, пока все растворенное вещество не растворится.
- г растворенного вещества = (масс.% раствора) x (мл воды) ÷ (100 – масс.% раствора)
- грамма NaCl = (10) x (100) ÷ (100 – 10) = 11,1 г
- Моя учетная запись
Войдите или зарегистрируйтесь сейчас, чтобы максимально сэкономить и получить доступ к информации профиля, истории заказов, отслеживанию, спискам покупок и многому другому.
Авторизоваться Завести аккаунт
- Обслуживание и поддержка
Свяжитесь с нами
Наша служба поддержки клиентов работает с 8:00 до 18:30 по восточноевропейскому времени с понедельника по пятницу. Онлайн-чат доступен с 8:00 до 17:30 по восточному времени с понедельника по пятницу.
- Телефон:
- 800.334.5551
- Факс:
- 800.222.7112
- Электронная почта:
- Электронная почта Служба поддержки клиентов
Подробнее Обслуживание и поддержка
Международные продажи и обслуживание
Мы обслуживаем преподавателей более чем в 170 странах мира.
 Создать предложение
запросите на нашем веб-сайте или свяжитесь с нашим международным отделом продаж.
Создать предложение
запросите на нашем веб-сайте или свяжитесь с нашим международным отделом продаж.Международная информация для заказа
- Покупки
СпискиВойдите или зарегистрируйтесь сейчас, чтобы максимально сэкономить и получить доступ к информации профиля, истории заказов, отслеживанию, спискам покупок и многому другому.
Авторизоваться Завести аккаунт
- Быстрый заказ
- Всегда надевайте соответствующие средства индивидуальной защиты (СИЗ) при работе с химическими веществами и приготовлении растворов.
 Используйте это руководство, чтобы выбрать средства индивидуальной защиты, соответствующие вашим потребностям.
Используйте это руководство, чтобы выбрать средства индивидуальной защиты, соответствующие вашим потребностям. - Дважды прочитайте этикетку на химическом веществе перед использованием. Прочтите его, когда берете химическое вещество с полки, и еще раз перед тем, как вынуть какое-либо химическое вещество из бутылки.
- При использовании концентрированных химикатов для приготовления растворов убедитесь, что вы медленно добавляете более концентрированный раствор к менее концентрированному. Обратная процедура может привести к закипанию и разбрызгиванию раствора.
Чтобы приготовить 1 М раствор гидроксида натрия, медленно добавьте 40 г гидроксида натрия к 500 мл дистиллированной или деионизированной воды в мерной колбе емкостью 1 л. Когда твердые вещества полностью растворятся и раствор станет комнатной температуры, разбавьте до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.
Чтобы приготовить 1 М раствор уксусной кислоты, растворите 60,05 г уксусной кислоты в 500 мл дистиллированной или деионизированной воды в мерной колбе вместимостью 1 л. Поскольку уксусная кислота является жидкостью, кислоту также можно измерять по объему.
 Разделите массу кислоты на ее плотность (1,049г/мл) для определения объема (57,24 мл). Для приготовления раствора используйте 60,05 г или 57,24 мл уксусной кислоты. Аккуратно встряхните колбу, чтобы перемешать раствор. Когда раствор станет комнатной температуры, разбавьте его до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.
Разделите массу кислоты на ее плотность (1,049г/мл) для определения объема (57,24 мл). Для приготовления раствора используйте 60,05 г или 57,24 мл уксусной кислоты. Аккуратно встряхните колбу, чтобы перемешать раствор. Когда раствор станет комнатной температуры, разбавьте его до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.- количество молей химических веществ, присутствующих в концентрированном растворе, равно количеству молей химических веществ, присутствующих в разбавленном растворе
- Vol con M con = V dil M dil
 1.2:
1.2:Резюме
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражаются как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходный раствор ) до желаемого конечного объема.
Key Takeaway
Концептуальные проблемы
Ответить
Численные задачи
Ответы
Авторы
Изменено Джошуа Халперном, Скоттом Синексом и Скоттом Джонсоном
Химический, молярный и весовой проценты
Растворы представляют собой гомогенные (равномерно распределенные) смеси двух или более химических веществ. Растворы могут существовать в виде твердых тел, жидкостей или газов.
Все растворы содержат растворитель и одно или несколько растворенных веществ. Растворитель, часто вода, является наиболее распространенным химическим веществом. Растворенное вещество — это химическое вещество (я), которое менее распространено.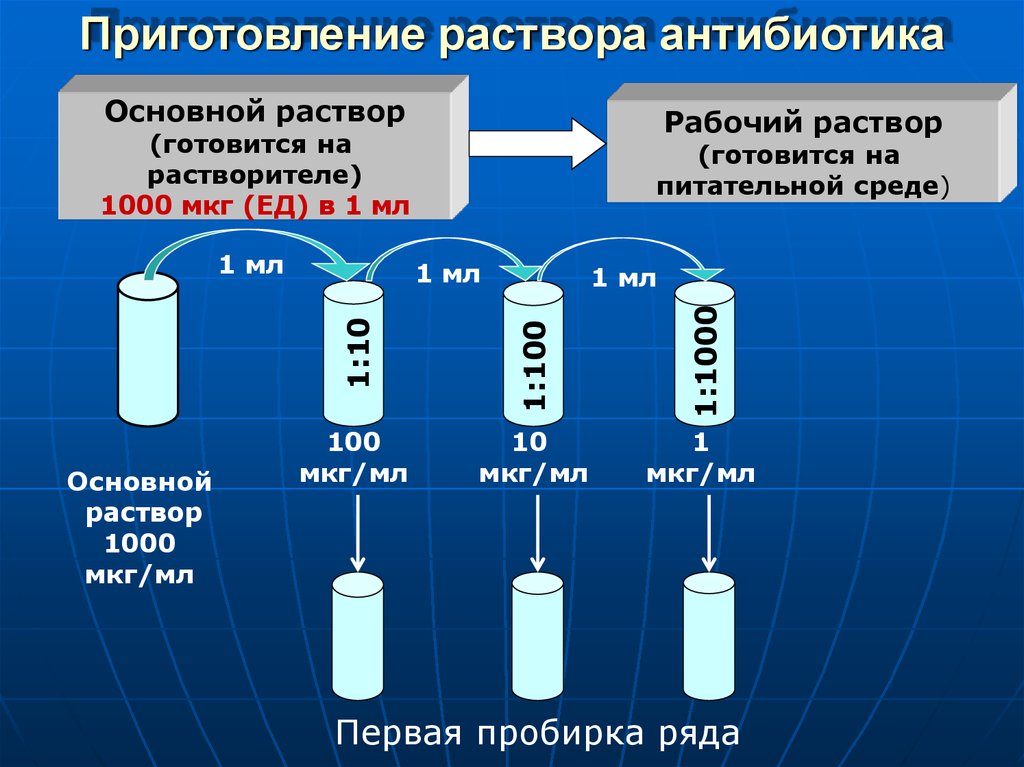
Приготовление растворов
Как растворять твердые вещества и уменьшать масштабы экспериментов
Для экспериментов часто требуется растворять растворенные вещества в твердой форме, чтобы приготовить растворы определенной концентрации (сила измеряется диссоциацией ионов). Запланируйте один час на каждые 2-4 решения, которые вам нужно подготовить. Вам понадобятся весы для взвешивания растворенного вещества и мерный цилиндр для измерения растворителя (если это вода).
Во-первых, определите концентрацию (весовой процент или молярность, см. ниже) и количество (миллилитров) раствора, который вам нужен, из вашей лабораторной процедуры. Во-вторых, рассчитайте необходимое количество растворенного вещества в граммах, используя одну из приведенных ниже формул. Затем взвесьте растворенное вещество и добавьте его в стакан для смешивания. Наконец, мерным цилиндром измерьте необходимый объем воды в миллилитрах и добавьте его в химический стакан. Перемешивайте раствор, пока все химикаты не растворятся.
Разбейте твердые комки химиката с помощью ступки и пестика или осторожно раздавите молотком в пластиковом пакете. Химические вещества растворяются быстрее при осторожном нагревании раствора и перемешивании.
Если для экспериментов требуется большое количество химикатов, можно уменьшить масштаб. Уменьшение масштаба снижает угрозы безопасности, затраты на химикаты и утилизацию отходов.
Большинство экспериментов можно сократить, разделив растворенное вещество и растворитель на коэффициент по вашему выбору. Например, эксперимент, требующий 50 г растворителя и 250 мл воды, можно уменьшить в 10 раз, чтобы в нем использовалось только 5 г растворителя и 25 мл воды. Вы можете упростить масштабирование, используя стаканы меньшего размера, пробирки и другое измерительное оборудование.
При приготовлении химических растворов всегда используйте соответствующее защитное оборудование.
Как приготовить молярные растворы
Молярные (М) растворы основаны на числе молей химического вещества в одном литре раствора. Моль состоит из 6,02×10 23 молекул или атомов. Молекулярная масса (MW) — это масса одного моля химического вещества. Определите молекулярную массу с помощью таблицы Менделеева, добавив атомную массу каждого атома в химическую формулу.
Моль состоит из 6,02×10 23 молекул или атомов. Молекулярная масса (MW) — это масса одного моля химического вещества. Определите молекулярную массу с помощью таблицы Менделеева, добавив атомную массу каждого атома в химическую формулу.
Пример: для молекулярной массы CaCl 2 , добавьте атомную массу Ca (40,01) к массе двух Cl (2 x 35,45), чтобы получить 110,91 г/моль. Следовательно, 1М раствор CaCl 2 состоит из 110,91 г CaCl 2 , растворенных в достаточном количестве воды, чтобы получился один литр раствора.
Когда молекулярная масса растворенного вещества известна, вес химического вещества, растворяемого в растворе для молярного раствора менее 1 М, рассчитывается по формуле:
Например, чтобы получить 100 мл 0,1 М раствора CaCl 2 , используйте предыдущую формулу, чтобы узнать, сколько CaCl 2 вам нужно:
Теперь можно приготовить раствор: растворите 1,11 г CaCl 2 в количестве воды, достаточном для получения 100 мл раствора. Необходимое количество воды будет чуть меньше 100 мл.
Необходимое количество воды будет чуть меньше 100 мл.
Весы и мерная колба используются для приготовления молярных растворов. Процедура приготовления молярного раствора в мерной колбе вместимостью 100 мл следующая:
Если у вас нет мерной колбы, вместо нее можно использовать мерный цилиндр на 100 мл. Просто добавьте растворенное вещество в градуированный цилиндр, а затем добавьте дистиллированную воду, пока не достигнете отметки 100 мл на стенке цилиндра.
Как приготовить весовые проценты (вес.%) растворов
В весовых процентах растворов вес растворенного вещества делится на вес раствора (растворенное вещество + вода) и умножается на 100. Поскольку плотность воды равна 1 г/мл, формула для расчета количества растворенного вещества, которое необходимо смешать для получения раствора в процентах по массе:
Например, чтобы приготовить 100 мл 10% раствора NaCl (поваренной соли), используйте предыдущую формулу, чтобы узнать, сколько NaCl вам нужно:
Теперь можно приготовить раствор: растворите 11,1 г NaCl в 100 мл воды.
Создайте собственное решение для следующих проектов:
Frozen Bubbles
Rainbow Reaction
Биологический тест на токсичность
Гальваническое покрытие: ключ с медным покрытием
Руководство по приготовлению раствора | Carolina.
 com Руководство по приготовлению раствора | Каролина.com
com Руководство по приготовлению раствора | Каролина.comКаролина предлагает множество типов готовых решений, но некоторые учителя предпочитают создавать свои собственные. Если это вас интересует, продолжайте читать. Это краткое руководство предоставит вам информацию, необходимую для создания ряда решений, обычно используемых в учебных лабораториях.
Рассмотрим некоторые соображения безопасности:
Подготовка раствора
Молярные растворы
Молярность (M) означает количество молей растворенного вещества на литр раствора. Для приготовления 1 М раствора медленно добавляют 1 формульную массу соединения в чистую мерную колбу емкостью 1 л, наполовину заполненную дистиллированной или деионизированной водой. Дайте соединению полностью раствориться, осторожно встряхивая колбу, если это необходимо. Когда растворенное вещество полностью растворится и раствор станет комнатной температуры, разбавьте его водой до метки. Вставьте пробку и, положив большой палец на пробку, а руку на горлышко колбы. несколько раз перевернуть колбу для перемешивания. Вот несколько примеров использования этого метода:
Когда растворенное вещество полностью растворится и раствор станет комнатной температуры, разбавьте его водой до метки. Вставьте пробку и, положив большой палец на пробку, а руку на горлышко колбы. несколько раз перевернуть колбу для перемешивания. Вот несколько примеров использования этого метода:
Разведения
При приготовлении разбавления определите необходимый объем и молярную концентрацию полученного раствора. Используйте следующее уравнение, чтобы определить, сколько концентрированного реагента необходимо для приготовления разбавленного раствора,
, где M IS MOLARITY и MALLIT
Медленно добавьте рассчитанный объем концентрированного реагента в мерную колбу подходящего размера, наполовину заполненную дистиллированной или деионизированной водой, и перемешайте колбу. Как только раствор станет комнатной температуры, разбавьте его водой до метки, вставьте и закрутите пробку и несколько раз переверните колбу для перемешивания.
Как только раствор станет комнатной температуры, разбавьте его водой до метки, вставьте и закрутите пробку и несколько раз переверните колбу для перемешивания.
Например, какой объем 10 М уксусной кислоты требуется для приготовления 1,0 л 0,50 М уксусной кислоты?
10 М × В реагент = 0,50 М × 1,0 л
В реагент = 0,050 л = 50 мл
Объем 50 мл 10 М уксусной кислоты требуется для приготовления 1,0 л 0,50 М уксусной кислоты.
Рецепты обычных растворов
Для приготовления этих растворов медленно добавляйте необходимые ингредиенты в мерную колбу объемом 1 л, наполовину заполненную дистиллированной или деионизированной водой. Дайте ингредиентам полностью раствориться, осторожно встряхивая колбу при необходимости. Когда растворенное вещество полностью растворится и раствор станет комнатной температуры, разбавьте его водой до метки. Вставьте и закрепите пробку и переверните колбу несколько раз, чтобы перемешать.
Каждый реагент в следующей таблице связан с нашим онлайн-каталогом для получения дополнительной информации и удобной покупки. Для жидкостей мы указали размер 500 мл реагента или химиката класса ACS, упакованного в безопасную бутылку с пластиковым покрытием. Для гидроксида натрия мы указали 500-граммовый размер реактивного химиката. Могут быть доступны другие размеры и классы. Пожалуйста, обратитесь к нашим каталогам для получения дополнительной информации.
| Раствор | Количество для добавления на 1 л воды | Конечная концентрация |
| Уксусная кислота ледяная (17,4 М) | 5,7 мл уксусной кислоты | 0,1 М |
| 57 мл уксусной кислоты | 1 М | |
| Соляная кислота (12,1 М) | 8,3 мл соляной кислоты | 0,1 М |
| 83 мл соляной кислоты | 1 М | |
| 248 мл соляной кислоты | 3 М | |
| 496 мл соляной кислоты | 6 М | |
| Гидроксид натрия | 4 г гидроксида натрия | 0,1 М |
| 40 г гидроксида натрия | 1 М | |
| Серная кислота (18,1 М) | 56 мл серной кислоты | 1 М |
Независимо от того, решите ли вы сделать свои собственные решения или купить их у нас в готовом виде, вы найдете все, что вам нужно, в Carolina.
Загрузить руководство по приготовлению раствора
Shop Chemicals
Вам может понравиться
Вам также может понравиться
Соляная кислота, 3 М (9% об./об.), лабораторная чистота, 500 мл
Артикул № 867861
$9,65
Быстрый просмотр
Соляная кислота, 3 М (9% по объему), лабораторного качества, 1 л
Артикул № 867863
16,50 долларов США
Быстрый просмотр
Соляная кислота, 1 М (3% по объему), лабораторная чистота, 500 мл
Артикул № 847841
$6,75
Быстрый просмотр
Соляная кислота, 12,1 М, в стеклянной бутылке, класс ACS, 30 мл
Артикул № 867788
$6,30
Быстрый просмотр
Соляная кислота, 0,1 М (0,3 % по объему), лабораторная чистота, 500 мл
Артикул № 867821
$7,15
Быстрый просмотр
Соляная кислота, 1 М (3% по объему), лабораторного качества, 1 л
Артикул № 867843
$11,70
Быстрый просмотр
Соляная кислота, 6 М, лабораторная чистота, 500 мл
Артикул № 867868
$9,65
Быстрый просмотр
Соляная кислота, 0,1 М (0,3 % об.
 /об.), ч. д. а., 1 л
/об.), ч. д. а., 1 лАртикул № 867823
$9,65
Быстрый просмотр
Кислотный спирт, 3% соляная кислота в 95% этаноле, лабораторная чистота, 500 мл
Артикул № 841733
$18,60
Быстрый просмотр
Bromthymol Blue ChemCapsule, лабораторный класс, упаковка из 5 шт.
Артикул № 850120
48,95 долларов США
Быстрый просмотр
Бромтимоловый синий ChemCapsule, лабораторного качества, каждая
Артикул № 849180
6,50 долларов США
Быстрый просмотр
Соляная кислота, 12,1 М, в стеклянной бутылке, класс ACS, 500 мл
Артикул № 867790
$20,30
Быстрый просмотр
Соляная кислота, 0,07 М, флакон 30 мл, упаковка из 8 шт.
Артикул № 974070
40,12 доллара США
Быстрый просмотр
Соляная кислота, 12,1 М, в стеклянной бутылке, класс ACS, 2,5 л
Артикул № 867792
$35,35
Быстрый просмотр
Соляная кислота, 1,0 М, 500 мл
Артикул № 974462A
$13,25
Быстрый просмотр
Соляная кислота, 12,1 М, в безопасной бутылке с пластиковым покрытием, класс ACS, 500 мл
Артикул № 867791
22,70 доллара США
Быстрый просмотр
Соляная кислота, 10 М (30% об.
 /об.), лабораторного качества, 1 л
/об.), лабораторного качества, 1 лАртикул № 867893
$53,80
Быстрый просмотр
Соляная кислота, 12,1 М, в безопасной бутыли с пластиковым покрытием, класс ACS, 2,5 л
Артикул № 867793
46,25 долларов США
Быстрый просмотр
Соляная кислота, 6 М, лабораторного качества, 1 л
Артикул № 867870
15,80 долларов США
Быстрый просмотр
Загрузка…
Приготовление химических растворов
Лабораторные эксперименты и исследования часто требуют приготовления химических растворов. Мы рассмотрим приготовление этих химических растворов по весу (масса/объем) и по объему (объем/объем). В приведенном ниже глоссарии приводятся определения, чтобы знать, когда ваша работа требует их создания, а также наиболее точные молярные растворы.
К этому мы добавляем информацию, предназначенную для понимания того, как использовать шкалу рН при измерении кислотности или щелочности раствора.
Глоссарий, основные термины для понимания…
Растворенное вещество – Вещество, которое растворяется в растворе
Растворитель – Вещество, которое растворяет другое с образованием раствора. Например, в растворе сахара и воды вода является растворителем; сахар является растворенным веществом.
Раствор – Смесь двух или более чистых веществ. В растворе одно чистое вещество растворено в другом чистом веществе гомогенно. Например, в растворе сахара и воды раствор имеет одинаковую концентрацию повсюду, т.е. оно однородно.
Моль — Фундаментальная единица массы (например, «дюжина» для пекаря), используемая химиками. Этим термином обозначают большое количество элементарных частиц (атомов, молекул, ионов, электронов и т. д.) любого вещества. 1 моль равен 6,02 х 10 23 молекул этого вещества. (номер Авогадро).М
1 моль равен 6,02 х 10 23 молекул этого вещества. (номер Авогадро).М
Введение в приготовление растворов.
Многие эксперименты с химическими веществами требуют их использования в виде растворов. То есть два или более вещества смешиваются вместе в известных количествах. Это может включать взвешивание точного количества сухого материала или измерение точного количества жидкости. Точная подготовка растворов повысит безопасность эксперимента и шансы на успех.
Решение 1: использование весовых процентов (вес/объем)
Формула
Формула весовых процентов (вес/объем): [масса растворенного вещества (г) / объем раствора (мл)] x 100
Пример
10% раствор NaCl содержит десять граммов хлорида натрия, растворенных в 100 мл раствора.
Процедура
Взвесить 10 г хлорида натрия. Перелейте его в мерный цилиндр или мерную колбу, содержащую примерно 80 мл воды. После полного растворения хлорида натрия (при необходимости осторожно встряхните колбу) добавьте воды, чтобы довести объем до окончательных 100 мл. Внимание: не просто измеряйте 100 мл воды и добавить 10 г хлорида натрия. Это приведет к ошибке, потому что добавление твердого вещества изменит конечный объем раствора и отбросит окончательный процент.
Внимание: не просто измеряйте 100 мл воды и добавить 10 г хлорида натрия. Это приведет к ошибке, потому что добавление твердого вещества изменит конечный объем раствора и отбросит окончательный процент.
Решение 2: Использование объемных процентов (об./об.)
Когда растворенное вещество является жидкостью, иногда удобно выражать концентрацию раствора в объемных процентах.
Формула
Формула для объемного процента (об./об.): [Объем растворенного вещества (мл) / Объем раствора (мл)] x 100
Пример
Приготовьте 1000 мл 5% по объему раствора этиленгликоля в воде.
Процедура
Сначала выразите процент растворенного вещества в виде десятичной дроби: 5% = 0,05
Умножьте эту десятичную дробь на общий объем: 0,05 x 1000 мл = 50 мл (необходим этиленгликоль).
Вычтите объем растворенного вещества (этиленгликоль) из общего объема раствора:
1000 мл (общий объем раствора) – 50 мл (объем этиленгликоля) = 950 мл (необходимая вода)
Растворите 50 мл этиленгликоля в чуть меньшем количестве 950 мл воды. Теперь доведите окончательный объем раствора до 1000 мл , добавив еще воды. (Это исключает любую ошибку, поскольку конечный объем раствора может не совпадать с рассчитанной суммой отдельных компонентов).
Теперь доведите окончательный объем раствора до 1000 мл , добавив еще воды. (Это исключает любую ошибку, поскольку конечный объем раствора может не совпадать с рассчитанной суммой отдельных компонентов).
Итак, 50 мл этиленгликоля / 1000 мл раствора x100 = 5% (об./об.) раствора этиленгликоля.
Раствор 3: Молярные растворы
Молярные растворы наиболее полезны при расчетах химических реакций, поскольку они напрямую связывают количество молей растворенного вещества с объемом раствора.
Формула
Формула молярности (М): количество молей растворенного вещества на 1 л раствора или грамм-молекулярная масса растворенного вещества на 1 л раствора.
Примеры
Молекулярная масса молекулы хлорида натрия (NaCl) равна 58,44, поэтому молекулярная масса одного грамма (=1 моль) равна 58,44 г. Мы знаем это, глядя на периодическую таблицу. Атомная масса (или вес) Na равна 22,99, атомная масса Cl равна 35,45, поэтому 22,99 + 35,45 = 58,44.
Если растворить 58,44 г NaCl в конечном объеме 1 литр , вы сделали 1M раствор NaCl , 1 молярный раствор.
Procedure
To make molar NaCl solutions of other concentrations dilute the mass of salt to 1000ml of solution as follows:
0.1M NaCl solution requires 0.1 x 58.44 g of NaCl = 5.844g
0,5 М раствора NaCl требуется 0,5 x 58,44 г NaCl = 29,22 г
2M раствор NaCl требуется 2,0 x 58,44 г NaCl = 116,88 г
Как приготовить раствор из стандартного раствора
Как приготовить раствор из ст… Как приготовить раствор из исходного раствора?
Исходный или стандартный раствор — это раствор, в котором вы точно знаете его концентрацию. Вы можете сделать маточные растворы в химической лаборатории или купить у производителей химикатов. Когда у вас есть исходный раствор, вы можете приготовить растворы более низкой концентрации, разбавив концентрированный исходный раствор.
Когда у вас есть исходный раствор, вы можете приготовить растворы более низкой концентрации, разбавив концентрированный исходный раствор.
Разбавлять означает добавлять определенное количество растворителя (воды) к определенному количеству концентрированного маточного раствора. Если вы добавите определенное количество растворителя к определенному количеству концентрированного исходного раствора, вы заметите, что количество растворенного вещества, присутствующего в исходном растворе, такое же, как и в разбавленном растворе. Разница лишь в том, что разбавленный раствор теперь содержит больше воды, чем исходный раствор, из которого он был приготовлен. В реальной жизни то, что вы только что прочитали, похоже на то, как вы добавляете больше воды в кофе или чай, чтобы осветлить его вкус. Добавляя больше воды, вы увеличиваете только количество воды в растворе, но не количество присутствующих в нем молекул кофе или чая. Вот иллюстрация разбавленного раствора, приготовленного из маточного раствора:
На приведенном выше рисунке видно, что в концентрированном растворе содержится 7 молекул растворенного вещества, а в разбавленном — 7 молекул. Но в разбавленном растворе растворителя больше, чем в концентрированном.
Но в разбавленном растворе растворителя больше, чем в концентрированном.
Поскольку оба раствора содержат одинаковое количество растворенных молекул, отсюда следует, что:
Если мы переведем предыдущее утверждение в математическое выражение, получим:
моль концентрированного раствора = моль разбавленного раствора
Но так как мы знаем, что количество раствора кофе в молях равно объему раствора, умноженному на его концентрацию в Молярности, то мы можем написать, что:
Объем (V) концентрированного раствора, умноженный на молярность (M) концентрированного раствора, равен объему (V) разбавленного раствора, умноженному на молярность (M) разбавленного раствора. Если мы переведем это в математическое выражение, то получим:
Расчет концентрации разбавленного раствора Как вы могли заметить, формула, которую мы только что вывели, является общей формулой для разбавления концентрированного раствора до раствора с меньшей концентрацией. Обратите внимание, что если вы указываете концентрацию раствора как 2 M , прописные буквы M часто используются для представления единицы (моль/л), которая является единицей концентрации, выраженной в молярности.
Обратите внимание, что если вы указываете концентрацию раствора как 2 M , прописные буквы M часто используются для представления единицы (моль/л), которая является единицей концентрации, выраженной в молярности.
Чтобы использовать формулу разбавления, вы должны знать как минимум три из четырех переменных в ней. Теперь давайте воспользуемся им, чтобы ответить на следующий вопрос:
Предположим, что в одном из ваших экспериментов по общей химии вам нужно использовать 2 М серную кислоту (H 2 SO 4 ) для определенной реакции, но ваш инструктор дал определенную реакцию вы 5 M H 2 SO 4 . Как бы вы это сделали?
Раствор
Поскольку из вопроса вы знаете нужную вам концентрацию серной кислоты, то следует определиться с тем, какой объем вам нужен. Итак, допустим, вам нужно 10 мл 2 M H 2 СО 4 . Из этого следует, что вы должны рассчитать объем исходного раствора, который вам нужно пипетировать, чтобы приготовить целевую концентрацию. Для этого необходимо вспомнить формулу разбавления. This formula says that:
Итак, допустим, вам нужно 10 мл 2 M H 2 СО 4 . Из этого следует, что вы должны рассчитать объем исходного раствора, который вам нужно пипетировать, чтобы приготовить целевую концентрацию. Для этого необходимо вспомнить формулу разбавления. This formula says that:
Now, if you read the вопрос еще раз, вы заметите, что все единицы соответствуют тому, что нам нужно вычислить. По этой причине нет необходимости конвертировать между единицами измерения. Следовательно:
Том с =? (Нам нужно рассчитать, сколько запаса нам нужно)
Vol dil = 10 мл (это объем 2 М концентрации, который вам нужен)
M con = 5 M (это молярность концентрированный раствор)
M dil = 2 M (Молярность разбавленного раствора)
Если мы подставим приведенную выше информацию в формулу разбавления, мы получим
Так как нам нужен объем концентрированного маточного раствора ( Том con ), мы должны разделить как левую, так и правую часть знака равенства в вышеприведенном уравнении (1) на 5 М. Если мы это сделаем, то получим:
Если мы это сделаем, то получим:
Из расчета нужно пипетировать 4 мл 5 М раствор серной кислоты, чтобы приготовить 10 мл 2 М раствора серной кислоты. Чтобы приготовить 10 мл 2 М раствора, необходимо сначала перенести около 5 мл дистиллированной воды в мерную колбу на 10 мл. Затем медленно добавьте 4 мл маточного раствора (серной кислоты). Встряхните колбу, а затем долейте дистиллированной воды до отметки 10 мл.
Внимание!
Как вы могли заметить, мы добавляли серную кислоту в дистиллированную воду в мерной колбе, а не наоборот. Почему?
Мы сделали это, чтобы раствор не взорвался. Как вы, возможно, знаете, серная кислота намного плотнее воды, поэтому, когда вы добавляете ее в воду, ее молекулы могут перемещаться внутри и хорошо смешиваться с молекулами воды. Однако, поскольку плотность воды меньше, чем у серной кислоты, если вы добавите ее к серной кислоте, ее молекулы создадут барьер, в котором вода окажется сверху, а серная кислота снизу. Этот нежелательный барьер может вызвать взрывную реакцию двух химических веществ (экзотермическая реакция), вырабатывая достаточно энергии, чтобы разбить колбу. По-другому вы можете предотвратить эту реакцию, поместив мерную колбу в баню со льдом и добавляя кислоту в дистиллированную воду. Лед будет поглощать энергию, выделяемую раствором, в результате чего раствор охлаждается.
Этот нежелательный барьер может вызвать взрывную реакцию двух химических веществ (экзотермическая реакция), вырабатывая достаточно энергии, чтобы разбить колбу. По-другому вы можете предотвратить эту реакцию, поместив мерную колбу в баню со льдом и добавляя кислоту в дистиллированную воду. Лед будет поглощать энергию, выделяемую раствором, в результате чего раствор охлаждается.
Чтобы узнать, как приготовить раствор из твердого вещества, нажмите здесь.
Примеры приготовления растворов
Здесь представлены два простых примера. Третий Пример представляет собой комплексное решение, для которого описание перечисляет концентрации компонентов используя разные выражения.
Масса по объему: Приготовить 2 литра 0,85% натрия хлорид
Если 1% определяется как 1 грамм на 100 мл, 0,85% составляет 0,85 грамма на 100 мл. Так как два литра 20-кратный объем 100 мл, нам нужно 20 х 0,85 граммов, что составляет 17 граммов NaCl. Для этого количества
мы можем использовать верхний баланс загрузки или даже
баланс поездки.
Для этого количества
мы можем использовать верхний баланс загрузки или даже
баланс поездки.Типичные электронные весы имеют точность до единицы. сотые доли грамма, что достаточно точно для взвешивания 17 грамм. Сначала «тарируем» прибор, поместив весовую лодочку на поддон и установить его на «ноль». мы не хотят загрязнить наши химические запасы, поэтому мы либо очистить шпатель или ложку перед погружением в контейнер или мы просто встряхиваем химикат выйти на лодку.
Предположим, что мы выпустили 16,97 грамма NaCl. Должен
мы прилагаем все усилия, чтобы получить последние 0,03 грамма?
Неа! Учтите, что если бы это было
необходимо, чтобы быть более точным, мы бы описали
формула как что-то вроде 0,846% NaCl или, может быть,
0,8495%. Если есть какое-то преимущество в точности
тогда мы должны проявить точность, иначе мы попытаемся
быть слишком точным просто пустая трата времени.
Помните, как использовать значащие цифры? Семнадцать грамм означает больше 16,5 грамм и меньше 17,5 грамм. Если мы хотим быть более точными, мы напишет «17,0» грамм, что означает больше больше или равно 16,95 грамма и меньше или равно до 17,05 грамм.
Молярность: Приготовьте 200 мл 70 мМ сахарозы
Предположим, вам нужно 200 миллилитров 70 мМ раствор сахарозы. Двести миллилитров составляет 0,2 л, а 70 мМ составляет 0,07 М. Молекулярная масса сахарозы можно определить по ее хим. формула, а именно C12h32O11 и атомные массы углерода, водорода и кислорода. Формула вес сахарозы идентичен ее молекулярному веса, а именно 342,3 грамма на моль. Решение 1М будет состоять из 342,3 г сахарозы в одном литр конечного объема.
Концентрация 70 мМ соответствует 0,07 моль за литр. Возьмите 0,07 моль/л на 342,3 грамма. на моль, и вам нужно 23,96 грамма на литр. Чтобы умножить 200 миллилитров вашего раствора грамм/литр на необходимые литры. Начиная с 200 миллилитров составляет 0,2 л, умножьте 23,96 грамма на 0,2 л, чтобы получить 4,792. нужны граммы. Так как типичный электронный весы отображают массу с точностью до 0,01 грамма, взвешиваемое количество следует округлить до 4,79граммов, хотя это вполне приемлемо и возможно, даже предпочтительнее округлить до 4,8 грамма.
Комплексный раствор: Подготовьте буфер для образцов для SDS-СТРАНИЦА
Следующая формула описывает состав
2-кратного концентрированного буфера, который мы используем для денатурации
белки для электрофореза. Описание формулы
v/v или w/w не будут указаны в разделе методов
так как очевидно, какие компоненты являются жидкостями
или твердые вещества.
50% (об./об.) концентрированный гель-буфер SDS-PAGE для стопинга,
рН 6,8
4,6% (вес/объем) додецилсульфат натрия
20% (об/об) глицерин
160 мМ дитиотреитола (реактив Клеланда)
0,01% краситель бромфеноловый синий
На 100 мл буфера для образцов 125 мл Эрленмейера
колба является подходящим сосудом для смешивания. жидкость
компоненты будут занимать 70% от общего объема
поэтому мы начинаем с размещения 50 мл гелевого буфера для укладки.
и 20 мл глицерина в колбе. Глицерин очень
вязкий, поэтому, чтобы быть точным, вы можете использовать шприц
доставить вещи. Нам нужно 4,6 грамма (4,6%)
додецилсульфата натрия (также называемого лаурилсульфатом).
Для равномерного перемешивания его следует добавлять при помешивании.
решение. Концентрация красителя также
дается как вес в объеме. Одна сотая 1%
составляет всего 0,1 мг/мл. Вам понадобится всего 10 мг.
Поскольку бромфеноловый синий служит индикатором
краситель и его концентрация не критична, вы
может весить что-то близкое к 10 мг или просто
используйте «щепотку», добавляя количество на узкой
конец шпателя.
Одна сотая 1%
составляет всего 0,1 мг/мл. Вам понадобится всего 10 мг.
Поскольку бромфеноловый синий служит индикатором
краситель и его концентрация не критична, вы
может весить что-то близкое к 10 мг или просто
используйте «щепотку», добавляя количество на узкой
конец шпателя.
Вес формулы реактива Клеланда равен 154. грамм/моль. Количество взвешивания определяется как (0,16 моль/л)(0,1 л)(154 г/моль) = 2,46 г (расчеты до 2,5 г).
Большую часть времени нет необходимости нагревать
раствор, чтобы смешать его, но в этом случае моющее средство
не переходит в раствор полностью, пока не
с подогревом. После помещения колбы в микроволновку
духовке в течение минуты или около того при низкой температуре и помешивании
немного раствор должен быть готов влить в
градуированный цилиндр на 100 мл для доливки
дистиллированная вода.



 3.6, см3
3.6, см3 3.2, см3
3.2, см3 3.7, см3
3.7, см3 Кардинально цвет не поменяется, но можно добиться интересного оттенка.
Кардинально цвет не поменяется, но можно добиться интересного оттенка.

 Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
 Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор содержит Ca(OCl) 2 концентрация 3,4 г на 100 мл раствора, какова молярность гипохлорита? is?
is?