Пропорции цементного раствора – как самостоятельно приготовить цементный раствор для фундамента (расход, пропорции)
При заливке фундамента основным стройматериалом является цемент. От его качества зависит надежность всей конструкции.
Из чего состоит цемент и его виды
Цемент – это искусственное вещество, обладающее вяжущими свойствами. Его получают производственным путем, измельчая клинкер, гипс и различные добавки.
В зависимости от особенностей производства и состава цемента выделяют несколько его видов. Для строительства фундаментов используют такиевиды цемента:
- водонепроницаемый безусадочный – обладает гидроизоляционными свойствами, выдерживает большие нагрузки;
- расширяющийся – увеличивается в объеме, заполняя все отверстия. Применяют при возведении свайных оснований зданий;
- портландцемент – сыпучий стройматериал, получаемый путем помола клинкера и содержащий в своем составе различные добавки.

Из-за своих свойств наибольшее распространение получил последний вид. Он широко применяется в капитальном строительстве, производстве железобетонных конструкций общего назначения, а также при заливке различных типов фундаментов. В составе цемента этого вида содержатся различные добавки, обусловливающие дополнительные свойства данного материала. Из наиболее часто применяемых видов можно отметить:
- сульфатостойкий – обладает повышенной сопротивляемостью к воздействию солей. Незаменим при строительстве в местах высокого залегания грунтовых вод;
- пластифицированный – за счет добавок обладает повышенной пластичностью, что позволяет снизить водосодержание смеси. Это придает фундаменту повышенную морозостойкость и прочность;
- напрягающий – массы из него быстро твердеют и быстро схватываются. Это позволяет ускорить строительные работы, однако негативно сказывается на надежности конструкции.
Как приготовить раствор
В зависимости от качеств, которыми должна обладать смесь, может изменяться ее состав.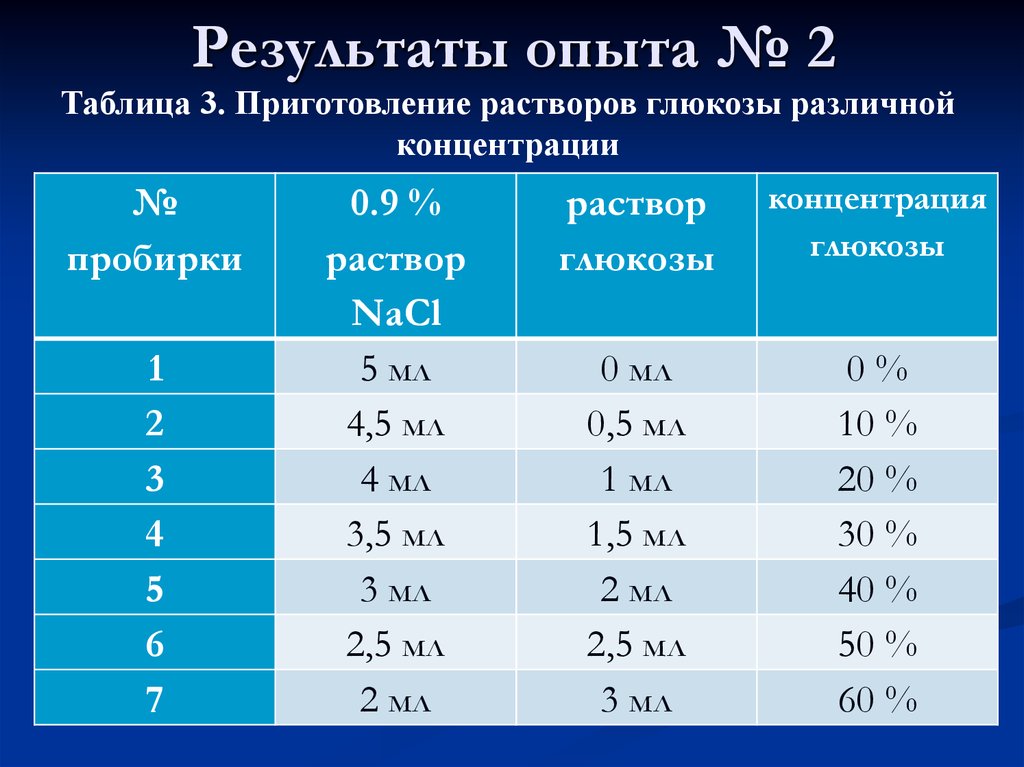
- цемент – основной связующий материал;
- песок – преимущественно используется речной или намывной;
- щебень – наполнитель, который существенно повышает прочность основания здания;
- вода – элемент, которым затворяют сухую смесь.
Кроме этих материалов в состав могут добавляться различные присадки, например пластификаторы или отвердители.
Чтобы самостоятельно замешать раствор, в подготовленную емкость наливают воду с добавками. В нее насыпают предварительно смешанный с песком цемент – столько, сколько необходимо в соответствии с приготавливаемой маркой. Массу замешивают лопатой до однообразной консистенции средней густоты. После этого в нее вводят щебень, тщательно перемешивают и раствор готов к заливке. Хорошо, если у вас есть возможность использовать бетономешалку – она не только сократит время работы и в разы снизит трудозатраты, но и повысит прочность готовой смеси за счет более качественного смешивания ингредиентов.
Пропорции составляющих и расход цемента на 1м3
Классическим вариантом бетона считается следование таким пропорциям:
- 1 часть основного вяжущего вещества;
- 2 часть песка;
- 2.5 части щебня.
Такое соотношение позволяет получить бетон марки М450, которая отличается повышенной прочностью. Учитывая пропорции расхода стройматериалов, для производства раствора понадобится 400 кг цемента (8 мешков по 50 кг), 800 кг песка и одна тонна щебня.
Если фундамент не будет испытывать нагрузку в 450 кг/см2, то целесообразно использовать бетон более низких марок. Рекомендуют такие пропорции расхода материалов при замешивании легких бетонов:
- М100: цемент – 220 кг (5 мешков по 50 кг), песок – 0,6 м3, щебень – 0,8 м3;
- М200: цемент – 280 кг (6 мешков по 50 кг), песок – 0,5 м3, щебень – 0,8 м3;
- М300: цемент – 380 кг (8 мешков по 50 кг), песок – 0,45 м3, щебень – 0,8 м3.

Чтобы определить расход сыпучих составляющих для приготовления 1м3 раствора, необходимо во время первого замеса постепенно добавлять ингредиенты, точно учитывая их расход. Для определения объема традиционно применяют 10 л ведра. Предположим, что необходимо развести раствор с соотношением 1:4. Выход в емкости для замеса или бетономешалке 10 ведер (0,1 куб). Сначала в бетономешалку необходимо насыпать 2 ведра щебня (0,02 куба), налить 5 л воды (0,0005 куба). При постоянном перемешивании добавляют 3,5 ведра песка (0,035 куба) и 9 л цемента (0,009 куба). Все ингредиенты перемешиваются, пока не получится однородная масса. При необходимости надо добавлять стройматериалы, придерживаясь соотношения, фиксируя все действия. После завершения замешивания можно рассчитать, сколько и каких ингредиентов потребовалось для того, чтобы развести 1 куб раствора. Исходя из этого соотношения, нужно сделать расчет расхода ингредиентов на 1м3 бетонной массы.
Перед тем как сделать закупку главного вяжущего вещества, следует точно рассчитать, сколько его понадобится, учитывая фасовку в мешках по 50 кг. Помня о пропорциях, заказывают и остальные сыпучие материалы.
Помня о пропорциях, заказывают и остальные сыпучие материалы.
Чтобы сделать заливку фундамента, нужно провести массу расчетов. Любая ошибка отразится на качестве основания здания, подвергнет опасности всё строение, сократит срок его эксплуатации. Поэтому нужно очень точно посчитать, сколько сыпучих стройматериалов понадобится для возведения цоколя. Самостоятельно сделать это сложно. Поэтому целесообразно обращаться за помощью к профессиональным строителям, которые не только выберут оптимальное соотношение ингредиентов, но и помогут сэкономить время и сохранить ваши силы при заливке фундамента.
Заказать услуги рабочих можно на сайте YouDo, поместив там объявление. Укажите в нем работу, которую требуется сделать, ее объем, цену за выполнение и другие параметры. Юду – это удобный сервис для поиска исполнителей, который сделает вашу жизнь легче.
Приготовление раствора из кристаллогидрата | Задачи 406
Задача 406.
Для приготовления 5%-ного (по массе) раствора MgSO4 взято 400 г MgSO4 .
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением:
m(в-ва) = . m(кристаллогидрата),
где – массовая доля соли в кристаллогидрате, которую можно определить по формуле:
Тогда
Масса MgSO4 в 400г MgSO4. 7Н2О будет равна:
m(MgSO4) = . m(MgSO4. 7Н2О) = 0,487 .400 = 195,443г.
Для расчета массы раствора используем формулу:
,
где
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Отсюда
Ответ: 3,9кг.
Задача 407.
Сколько молей MgSO4. 7Н2О надо прибавить к 100 молям воды, чтобы получить 10%-ный (по массе) раствор MgSO4?
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением:
m(в-ва) = . m(кристаллогидрата),
где
– массовая доля соли в кристаллогидрате, которую можно определить по формуле:
Тогда
Для расчета массы кристаллогидрата используем формулу:
,
где
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Обозначим массу кристаллогидрата MgSO4.
Тогда рассчитаем массовую долю MgSO4, подставив соответствующие значения в уравнение, получим
Для расчета количества кристаллогидрата используем формулу:
Отсюда
Ответ: 1,88 моль.
Задача 408.
Определить массовую долю CuSO4 в растворе, полученном при растворении 50г медного купороса CuSO4. 5H2O в 450г воды
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением: m(в-ва) = . m(кристаллогидрата) , где – массовая доля соли в кристаллогидрате, которую можно определить по формуле:
Тогда
Масса раствора равна:
m(CuSO4) = . m(CuSO4. 5H2O) = 0,666 . 50 – 33,3г.
Массовую долю CuSO4 находим из уравнения:
,
где
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Отсюда
Ответ: 6,66%.
Задача 409.
В какой массе воды нужно растворить 25г CuSO4 . 5H2O, чтобы получить 8%-ный (по массе) раствор CuSO4?Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением: m
Тогда масса CuSO4, содержащаяся в 25г медного купороса равна:
m(CuSO4) = .m(CuSO4 . 5H2O) = 0,666 . 25 – 16,65г.
25 – 16,65г.
Массу полученного раствора находим из уравнения:
,
где
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Отсюда масса раствора равна:
Тогда масса воды, которую необходимо прибавить к 25 г медного купороса, будет равна:
208,125 – 25 = 183,125г.
Ответ: 183,125г.
Задача 410.
Сколько граммов Na2SO4.10H2O надо растворить в 800г воды, чтобы получить 10%-ный (по массе) раствор Na2SO4?
Решение:
Масса растворённого в растворителе вещества и масса кристаллогидрата связаны между собой простым соотношением:
m(в-ва) = . m(кристаллогидрата),
где – массовая доля соли в кристаллогидрате, которую можно определить по формуле:
Для расчета массы кристаллогидрата используем формулу:
,
где
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Обозначим массу кристаллогидрата Na2SO4. 10H2O через х, а массу Na2SO4 через .x, получим выражение:
Ответ: 235,3г.
Как приготовить раствор для промывания носа
Промывание носа – простая гигиеническая процедура, позволяющая обеспечить увлажнение слизистой оболочки носовых ходов и придаточных пазух. Есть множество прописей и рецептур растворов, используемых для промывания носа. Ниже мы расскажем об особенностях тех или иных видов растворов для промывания носа.
Для промывания носа обычно используют изотонический (физиологический) или гипертонический растворы.
- Изотонический раствор (или просто физраствор) – это 0,9% раствор поваренной соли (NaCl) в воде.
- Гипертонический раствор – это 3,5% раствор поваренной (столовой) соли в воде.
 Проведенные исследования не продемонстрировали значимых преимуществ одного раствора перед другим, но было показано, что реснички эпителия носовых проходов лучше сокращаются после гипертонического раствора. Также гипертонический раствор оказался чуть лучше в лечении синуситов (гайморита, фронтита).
Проведенные исследования не продемонстрировали значимых преимуществ одного раствора перед другим, но было показано, что реснички эпителия носовых проходов лучше сокращаются после гипертонического раствора. Также гипертонический раствор оказался чуть лучше в лечении синуситов (гайморита, фронтита).
В нескольких исследованиях сравнивали изотонический раствор Рингера (Рингера-Локка) с обычным физраствором. Опять же незначительное преимущество было за раствором Рингера.
Нейтральный или щелочной раствор?
Некоторые врачи рекомендуют слегка подщелачивать раствор для промывания пищевой содой. В исследованиях было выявлено незначительное преимущество слабощелочных растворов (Ph 7,6-9) в сравнении с нейтральным.
Острый синусит. Симптомы, диагностика, лечение
Информация для пациентов. Что такое синусит. Какие бывают си…
Другие добавки в растворы для промывания носа
Антибактериальные и противогрибковые добавки
Попытки добавить к растворам антибактериальные средства (гентамицин, тобрамицин, бактробан) и противогрибковые (амфотерицин В) не продемонстрировали значимых преимуществ. Учитывая отсутствие очевидной или подтвержденной пользы, мы не рекомендуем использовать такие добавки в растворах для промывания носа.
Учитывая отсутствие очевидной или подтвержденной пользы, мы не рекомендуем использовать такие добавки в растворах для промывания носа.
Ксилит
Использование ксилита как добавки к раствору для промывания носа рассматривалась как заманчивая идея для получения дополнительной пользы, однако и в этом случае клинических подтверждений ожидаемых преимуществ получено не было.
Как приготовить раствор для промывания носа в домашних условиях
Прежде чем приступать к приготовлению растворов, тщательно вымойте руки и простерилизуйте посуду. Во всех представленных ниже рецептах присутствует поваренная соль (NaCl). Мы рекомендуем использовать обычную поваренную, не йодированную соль. Не используйте морскую соль, т.к. в ней присутствуют разные компоненты.
Обычный изотонический раствор для промывания носа
Обычный изотонический (физиологический) раствор – это 0,9% водный раствор NaCl (натрий хлор, обычная поваренная соль). Для его приготовления необходимо:
Для его приготовления необходимо:
Взять 991 мл чистой воды. Мы рекомендуем использовать бутилированную воду. Если она недоступна, можно взять водопроводную воду, которую следует прокипятить в течение 20 минут.
Воду следует остудить до комнатной температуре
9 грамм поваренной соли добавьте приготовленную воду. Помешивайте до растворения соли.
Раствор готов для использования. Его можно хранить в холодильнике, в закрытой посуде в течение 2-3х дней. После чего следует приготовить новую порцию.
В обычном физиологическом растворе, хранящемся при комнатной температуре бактерии, обнаруживаются уже через 24 часа.
ПРИМЕЧАНИЕ: учитывая цели, для которых готовится раствор, не будет большой ошибкой взять не 991 мл воды, а 1 литр. Не 9 грамм соли, а две чайные ложки (обычно в одной чайной ложке умещается примерно 5 грамм соли).
Раствор для промывания носа. Пропись Talbot и др.

В 1 литр воды кипяченой бутилированной воды добавить 2-3 чайной ложки поваренной соли и одну чайную ложку пищевой соды. Добиться полного растворения солей. Получен гипертонический 3% раствор для промывания носа.
Раствор для промывания носа. Пропись Rabago и др.
0,5 л воды 1 чайная ложка с горкой поваренной соли, ½ ч.л. пищевой соды. Добиться полного растворения солей. Получен гипертонический 2% раствор для промывания носа.
Промывание носа. За и против
Промывание носа часто упоминается как дополнительный метод л…
Полученные растворы, как физиологический, так и гипертонический, несмотря на содержание соли, не должны вызывать жжения и иных неприятных ощущений, т.к. соль в этих растворах в низкой концентрации. Для промывания следует использовать воду комнатной температуры.
Приготовление растворов | Основные лабораторные процедуры I
Химические лабораторные протоколы / Основные лабораторные методы
Этапы приготовления воды общего назначения решения:
- Выясните или примите решение о необходимой концентрации химиката и необходимая степень чистоты
- Определите необходимый объем раствора
- Узнать относительную молекулярную массу химического вещества
(М р ).
 Это сумма атомных (элементарных) масс
элемент(ы) компонента nd обычно можно найти на контейнере. Если
химическое вещество гидратировано, то есть имеет молекулы воды, связанные с
Это необходимо учитывать при расчете требуемой массы.
Это сумма атомных (элементарных) масс
элемент(ы) компонента nd обычно можно найти на контейнере. Если
химическое вещество гидратировано, то есть имеет молекулы воды, связанные с
Это необходимо учитывать при расчете требуемой массы. - Рассчитайте массу химиката, которая даст вам концентрацию в требуемом объеме, учитывая
обратите внимание на указанный процент чистоты химиката.
Пример 1: Предположим, ваша процедура требует подготовки 250 мл 0,1 моль л -1 раствора хлорида натрия
- Начните с выражения всех объемов в одних и тех же единицах измерения, либо миллилитры, либо литры (например, 250 мл как 0,25 л)
- Рассчитайте требуемое количество молей по уравнению [4.1]:01 = количество
(моль) ÷ 0,25.
Путем перестановки нужное количество моль, таким образом, 0,1 × 0,25 = 0,025 моль. - Преобразовать моль в г путем умножения на относительную молекулярную
масса (M r для NaCl = 58,44 г моль -1 ).

- Следовательно, нужно составить 0,025 × 58,44 = 1,46 г до 250 мл раствора с использованием дистиллированной воды
Пример 2 : Предположим, вам нужно приготовить 100 мл карбонат натрия (2М).- Перевести 2M в моль-л -1 ; необходимая концентрация = 2 моль л -1 .
- Выразите все объемы в одних и тех же единицах измерения: следовательно, 100 мл = 0,1 л.
- Рассчитайте необходимое количество молей по уравнению [4.1]:2 = количество (моль) ÷ 0,1. Путем перестановки нужное количество моль, таким образом, 2 × 0,1 = 0,2 моль.
- Преобразовать моль в г путем умножения на M r но Обратите внимание на контейнере, что соединение Na 2 CO 3 .10H 2 O. Поэтому М р обязательные должны включать кристаллизационную воду и M r = 286,14 г моль -1
- Следовательно, нужно составить 0,2 × 286,14 = 57,2 г до
100 мл раствора с использованием дистиллированной воды.

- Отвесить требуемую массу химиката до соответствующей
точность. Если масса слишком мала для взвешивания с желаемой степенью
точности рассмотрите следующие варианты:
- Приготовьте раствор на терке.
- Приготовьте более концентрированный раствор, который можно разбавлять поздняя стадия.
- Сначала взвесьте массу и рассчитайте, какой объем решение до последующего использования уравнения 4.1.
- Добавить химическое вещество в химический стакан или коническую колбу и затем требуемый объем. Если какое-то химическое вещество прилипает к взвешиванию емкости, используйте немного воды, чтобы смыть его. Для точного растворы для точного взвешивания и количественного переноса.
- Перемешать и, при необходимости, нагреть раствор, чтобы все
химически растворяется. Вы можете определить визуально, когда это произошло
наблюдая за исчезновением кристаллов или порошка. Разрешить
раствор охладить, если нагреть.

- Доведите растворы до нужного объема. Если концентрация
необходимо быть точным, используйте мерную колбу; если высокая степень
точность не требуется, используйте мерный цилиндр.
- Перелейте раствор из стакана в мерный сосуд с помощью воронку, чтобы избежать проливания, используя воду для промывания сосуда.
- Увеличьте объем так, чтобы мениск доходил до соответствующую измерительную линию. Если точность не является серьезной проблемой, деления на мензурке или конической колбе могут быть использованы для установить примерный объем.
- Перенесите раствор в бутыль для реагентов или коническую колбу и четко обозначьте судно, включая информацию об опасности, где соответствующий. Не используйте воду в этой последней передаче, так как вы изменить концентрацию раствора путем разбавления.
Требуемая концентрация, скорее всего, будет определяться вашим протоколом.
Также могут быть указаны следующие, а также класс химиката и поставщик. К
избегайте отходов, тщательно продумайте объем требуемого раствора, хотя это
всегда рекомендуется ошибаться в большую сторону, потому что вы можете пролить немного, сделать
ошибка при дозировании или необходимо повторить часть эксперимента. Выбери один
стандартных объемов для сосудов, так как это облегчит измерение.
К
избегайте отходов, тщательно продумайте объем требуемого раствора, хотя это
всегда рекомендуется ошибаться в большую сторону, потому что вы можете пролить немного, сделать
ошибка при дозировании или необходимо повторить часть эксперимента. Выбери один
стандартных объемов для сосудов, так как это облегчит измерение.
Использовать дистиллированную или деионизированную воду для приготовления водных растворов и перемешивания
чистой палочкой из стекла Pyrex® или магнитной мешалкой («блошиной») до тех пор, пока все
химикат растворяется. Магнитные мешалки являются удобным средством перемешивания
растворы, но следует принимать меры предосторожности для предотвращения потерь в результате разбрызгивания. Добавлять
блоху в пустой стакан или коническую колбу, добавьте химикат, а затем немного
вода. Поместите сосуд по центру пластины мешалки, включите мешалку и
постепенно увеличивайте скорость перемешивания. Когда кристаллы или порошок
растворяются, выключают мешалку и удаляют блох с помощью магнита. Заботиться
чтобы не загрязнить ваш раствор, когда вы это сделаете, и промойте блох в
раствор с дистиллированной водой. Вообще удобно использовать стеклянные палочки с мензурками – простота доступа для перемешивания – и магнитные блохи с коническими колбами –
меньшие потери из-за разбрызгивания – но часто это вопрос ваших предпочтений
и лабораторных навыков.
Заботиться
чтобы не загрязнить ваш раствор, когда вы это сделаете, и промойте блох в
раствор с дистиллированной водой. Вообще удобно использовать стеклянные палочки с мензурками – простота доступа для перемешивания – и магнитные блохи с коническими колбами –
меньшие потери из-за разбрызгивания – но часто это вопрос ваших предпочтений
и лабораторных навыков.
«Упрямые» растворы могут потребовать нагрева, но делайте это только в том случае, если знаете что химическое вещество не будет повреждено при используемой температуре. Используйте нагреватель-мешалку, чтобы поддерживать раствор в перемешиваемом состоянии при его нагревании. Дайте раствору остыть до комнатной температуры, прежде чем окончательно определить его объем.
Ключевые особенности подготовки растворов для аналитических целей:
- Убедитесь, что у вас есть самые точные доступные знания о массы используемых химикатов.
- Убедитесь, что у вас есть самые точные доступные сведения о
объемы используемых растворов.

Для достижения этих свойств используются точные приемы взвешивания и переноса раствора. необходимо использовать, и процедура проиллюстрирована в следующем примере.
‘Приготовить стандартный раствор (250,00 мл) аммония двухвалентного сульфат (приблизительно 0,1 М), который следует использовать для определения концентрирование раствора перманганата калия титрованием».
Вы должны знать следующую встроенную информацию:
- Это количественный эксперимент, поэтому требуется аналитическое решение быть подготовленным.
- Вы должны использовать мерную колбу вместимостью 250,00 мл, которую следует откалиброван при 20°C.
- Вы должны точно взвесить с точностью до четырех знаков после запятой массу хим.
- Практически невозможно взвесить точную массу химического вещества для конкретного
концентрация. Например, масса (NH 4 ) 2 FeS0 4 .6H 2 0 требуется для
приготовить 250,00 мл 0,1 М раствора – это 9,8035 г, и вы не можете взвесить
из этой точной массы.
 Однако вы можете взвесить известную массу до четырех
десятичные знаки точно. Отсюда можно точно рассчитать
концентрация химического вещества в растворе, так как вы будете знать массу
и объема с высокой степенью точности.
Однако вы можете взвесить известную массу до четырех
десятичные знаки точно. Отсюда можно точно рассчитать
концентрация химического вещества в растворе, так как вы будете знать массу
и объема с высокой степенью точности.
Главный практический момент заключается в том, что вы не должны потерять из-за разбрызгивания или невозможности
перенос при неадекватном полоскании, любой раствора, приготовленного в
химический стакан, и вы должны перенести все раствора путем повторного ополаскивания в
мерная колба. Поэтому рекомендуется использовать для перемешивания только стеклянную палочку.
раствор осторожно растворить твердое вещество и использовать стеклянную палочку, как показано на
Рис. 4.1, чтобы залить раствор в фильтрующую воронку. Эта техника, с
практике, предотвращает потери раствора вниз по стенке стакана через
носик; ополаскивание водой может быть достигнуто с помощью промывочной бутылки
прямо в стакан. Не следует использовать блох для размешивания раствора при приготовлении стандартное решение, так как это вводит больше шагов стирки – стирка блох и ‘блошиный экстрактор’ – и вам еще нужно использовать стеклянную палочку для количественный перенос. Методика приготовления стандартного раствора приведена ниже. Процедура: Как приготовить водный раствор известная концентрация твердого химического вещества для использования в количественном анализ. |
|
Пример: Предположим, вам нужно приготовить стандартный раствор
(250,00 мл) сульфата железа аммония (примерно 0,1 М), который
используется для определения концентрации раствора
перманганат калия.
- Это количественный эксперимент, поэтому железосодержащий аммоний сульфат должен быть самой высокой чистоты, доступной вам
- Рассчитайте массу химиката, которая даст вам желаемую концентрацию в требуемом объеме.
- Перевести 1,0M в моль-л -1 ; необходимая концентрация = 1,0,ол л -1
- Выразите все объемы в одних и тех же единицах измерения; поэтому 250,00 мл = 0,25 л
- Преобразовать необходимое количество молей из уравнения [4.1]: 1,0 = количество (моль) &делить 0,25. По перестановке; необходимое количество молей таким образом, 1,0 × 0,25 = 0,025 моль.
- Преобразуйте моль в г путем умножения на M r , но обратите внимание на контейнер, что соединение (NH 4 ) 2 FeS0 4 .6H 2 0. Поэтому требуемый M r должен включать кристаллизационной воды и M r = 392,14 г моль -1
- Следовательно, вам нужно взвесить 0,025 × 392,14 = 9,8035 г.
 (NH 4 ) 2 FeSO 4 .6H 2 0.
(NH 4 ) 2 FeSO 4 .6H 2 0.
- Поместите чистую, сухую лодочку для взвешивания или образец приблизительного размера трубку на простые весы с двумя десятичными знаками и обнулить (тарировать) уравновесить и взвесить около 9,80 г химиката.
- Осторожно перенесите пробирку с химикатом в четырехместную емкость. аналитические весы с десятичным знаком и запишите точную массу: скажем 11.9726г.
- Снимите образец и контейнер с весов и наклоните содержимое в чистую сухую мензурку (400 мл), следя за тем, чтобы не было вытекание за пределы стакана. Не пытайтесь промыть пробирка с водой.
- Немедленно повторно взвесьте пробирку с образцом на аналитических весах:
скажем 2.1564г. Это масса контейнера вместе с несколькими
кристаллы химического вещества, оставшиеся в контейнере.
Однако вы точно знаете массу химиката в стакане:
11,9726 − 2,1564 = 9,8162 г (NH 4 ) 2 FeS0 4 .
 6H 2 0,
6H 2 0, - добавьте деионизированную или дистиллированную воду (около 100 мл) в химический стакан и осторожно перемешайте миксер чистым Pyrex ® стеклянная палочка пока все твердое вещество не растворится. Не разбрызгивайте раствор или вы не можете рассчитать его концентрацию. Удалить стеклянную палочку из раствора, ополаскивая ее небольшим количеством дистиллированной воды в раствор.
- Зажмите чистую мерную колбу для поддержки и поместите чистую, сухую фильтрующая воронка в верхней части, поддерживаемая кольцом. Осторожно налейте раствор в мерную колбу, не допуская проливания раствора используя технику, показанную на рис. 4.1, и медленно заливая чтобы не образовывалась воздушная пробка и раствор не стекал по стенке стакан. Когда добавление завершено, не двигать стакан от его положения над воронкой.
- Несколько раз промыть стакан дистиллированной водой.
бутыль для промывки водой для переноса всего раствора в мерную
колбу, обращая особое внимание на «носик» и стеклянную палочку.
 затем
отставьте стакан в сторону и поднимите воронку из колбы, пока
промыв его дистиллированной водой. Теперь вы достигли количественного переноса . Встряхните жидкость в колбе, чтобы
предотвращения градиентов плотности.
затем
отставьте стакан в сторону и поднимите воронку из колбы, пока
промыв его дистиллированной водой. Теперь вы достигли количественного переноса . Встряхните жидкость в колбе, чтобы
предотвращения градиентов плотности. - Довести раствор до метки дистиллированной водой, пробка
колбу и тщательно перемешать, осторожно перевернув (10 раз)
колбу, удерживая пробку на месте.
Теперь у вас есть раствор (250,00 мл0, содержащий (NH 4 ) 2 FeS0 4 .6H 2 0 (9,8162 г). Концентрация этого раствора содержит 9,8162 г
(NH 4 ) 2 FeS0 4 .6H 2 0 .
Следовательно:
1000,00 мл раствора содержит (4 × 9.8162) = 39,2648 г (NH 4 ) 2 FeS0 4 .6H 2 0,
концентрация раствора:
39,2648 г/л -1 = 39,2648 &делить 392,14 = 0,1001 моль/л -1 = 0,1001 М .
Требуется процедура с аналитическими растворами, приготовленными из жидкостей В качестве альтернативы вы можете использовать бюкс, как показано на рис. 4.2. жидкость помещается в бутылку, точно взвешивается, а затем приблизительно необходимое количество добавляют в мерную колбу с растворителем. Мерную колбу немедленно закрывают пробкой, бюкс повторно взвешивают. и рассчитывается вес выдаваемой жидкости. Затем мерную колбу доводят до метки и закрывают пробкой. Теперь вы знаете концентрацию стандартное решение до четырех знаков после запятой. |
|
Поддержите наших разработчиков
Пошаговое руководство — The Lab Label
Краткое введение в решения
Чаще всего, когда вы начинаете работать в лаборатории в качестве студента или лаборанта, подготовьте различные растворы и маточные растворы (предварительно убедившись, что вы носите надлежащее защитное оборудование, такое как лабораторный халат, конечно – если он вам все еще нужен, отправляйтесь в наш магазин).
В лаборатории растворы повсюду. Буферы, реакционные смеси, среды для культивирования клеток, лизаты клеток, жидкие кислоты и основания — все это примеры растворов, обычно используемых в лаборатории.
Как только вы начнете, все виды работы в лаборатории станут увлекательными, но иногда некоторые задачи могут стать более повторяющимися, даже если они необходимы. Подготовка буферов и маточных растворов является одним из них!
Исходные растворы представляют собой концентрированные версии рабочих растворов, которые представляют собой более разбавленные версии исходных растворов. Естественно, вы можете использовать приготовленный маточный раствор самостоятельно или использовать его как компонент в более сложном растворе. Вы можете сделать партию, которую можно использовать много раз, так что не обращайте на меня внимания, если я скажу, что стандартные растворы значительно экономят время!
Чтобы избежать их постоянной подготовки, всякий раз, когда они нужны кому-то в лаборатории (что бывает ОЧЕНЬ часто!), они производятся в больших объемах/количествах. Они полезны для экономии места в вашем хранилище, так как вы всегда можете использовать раствор с более высоким запасом (например, 10X), чтобы сделать рабочий раствор (например, 1X). Еще одно большое преимущество заключается в том, что, используя стандартные растворы, вы сводите к минимуму различия между экспериментами, поскольку всегда используете одно и то же решение.
Они полезны для экономии места в вашем хранилище, так как вы всегда можете использовать раствор с более высоким запасом (например, 10X), чтобы сделать рабочий раствор (например, 1X). Еще одно большое преимущество заключается в том, что, используя стандартные растворы, вы сводите к минимуму различия между экспериментами, поскольку всегда используете одно и то же решение.
Мы подготовили краткое пошаговое руководство, которое поможет вам стать профессиональным миксером растворов!
Шаг 1: Рассчитайте
Прежде чем пачкать руки, вам нужно знать, как сделать раствор, чтобы получить раствор нужной концентрации. Первый шаг к приготовлению раствора — знать, сколько растворенного вещества вам нужно добавить или взвесить.
Для этого вам нужно будет использовать это простое уравнение:
Перетасовав уравнение и выделив только одно неизвестное, вы можете заполнить другие известные значения числами и найти решение! Используйте это уравнение для каждого компонента вашего решения в отдельности. Оставшаяся разница с вашим окончательным объемом — это объем воды, который вам нужно добавить на более позднем этапе.
Оставшаяся разница с вашим окончательным объемом — это объем воды, который вам нужно добавить на более позднем этапе.
Давайте вместе рассмотрим этот пример. Для вашего эксперимента вам нужно приготовить 50 миллилитров 2,5 М рабочего раствора из 10 М исходного раствора.
Первое, что вам нужно сделать, это рассчитать необходимый объем исходного раствора с помощью приведенной выше формулы. Попробуйте решить ее самостоятельно, прежде чем осматривать раствор ниже 😉
ОТВЕТ: Добавьте 12,5 мл исходного раствора 10M в мерную колбу на 50 мл и разбавьте ее до уровня 50 мл растворителем. Вуаля, ваше первое 2,5-мегапиксельное рабочее решение готово!
ПРИМЕЧАНИЕ. Вместо использования концентрации в этой формуле вы также можете использовать молярность (M), относительные концентрации (например, 10X, 50X,…) или любую другую единицу измерения. НО только в том случае, если они одинаковые с обеих сторон! При расчете также убедитесь, что все ваши единицы всегда согласованы 😊
Чаще всего делаются 10-кратные (относительная концентрация) исходные растворы, чтобы избежать сложных вычислений. Например, вы добавили бы 100 граммов растворенного вещества в 1000 мл воды, чтобы сделать 10%-й исходный раствор. Однако, если вы хотите приготовить раствор с другим процентным содержанием, вы следуете тем же рассуждениям.
Например, вы добавили бы 100 граммов растворенного вещества в 1000 мл воды, чтобы сделать 10%-й исходный раствор. Однако, если вы хотите приготовить раствор с другим процентным содержанием, вы следуете тем же рассуждениям.
Шаг 2: Взвесьте
Проверьте, откалиброваны ли весы, и, если вам повезет, взвесьте компоненты. Перед взвешиванием обязательно очистите весы. Будьте максимально точны!
Шаг 3: Растворите
Найдите химический стакан подходящего размера и наполните его примерно на 80-85% конечного объема. Таким образом, вам не нужно беспокоиться о превышении конечного объема при регулировке pH.
Перед смешиванием точно взвешенных компонентов бросьте чистую магнитную мешалку в химический стакан и наденьте ее на магнитную мешалку.
Теперь осталось дождаться полного растворения компонентов. Наконец-то можно сделать небольшой перерыв!
ПРИМЕЧАНИЕ. Всегда начинайте с меньшего объема, а затем заполняйте его позже, чтобы не превысить окончательный объем!
Шаг 4: Регулировка pH (необязательно)
Когда компоненты растворяются, pH необходимо регулировать в соответствии с рецептом. Это делается путем добавления капель концентрированной кислоты или основания при контроле изменения рН с помощью рН-метра. Будьте терпеливы и добавляйте в небольших количествах, рН быстро меняется!
Это делается путем добавления капель концентрированной кислоты или основания при контроле изменения рН с помощью рН-метра. Будьте терпеливы и добавляйте в небольших количествах, рН быстро меняется!
Этот шаг в основном выполняется при приготовлении буферов, а не при приготовлении простых маточных растворов.
Шаг 5: Отрегулируйте громкость
Еще немного, это почти последний шаг. Вы почти там!
После установки pH необходимо заполнить до конечного объема. Для этого вам нужно будет использовать градуированный цилиндр, так как он более точен.
СОВЕТ ДЛЯ ПРОФЕССИОНАЛОВ: чтобы магнитная мешалка не выпала из стакана при переливании раствора в градуированный цилиндр и не могла разбрызгаться или что-то сломать, держите большую магнитную мешалку снаружи стакана, чтобы удерживать ее на месте. !
Шаг 6: Промаркируйте и храните его
Аккуратно промаркируйте приготовленный раствор, указав его название, молярность, дату приготовления и срок годности. После этого сохраните его в указанном месте, чтобы каждый мог найти его и получить к нему доступ в любое время.
После этого сохраните его в указанном месте, чтобы каждый мог найти его и получить к нему доступ в любое время.
Шаг 7: Задокументируйте
В завершение аккуратно запишите все в лабораторный журнал. Таким образом, все хорошо задокументировано, и каждый может проверить, насколько хорошо вы поработали.
Как приготовить стандартный раствор?
Veerendra
Приготовление стандартного раствора методом взвешивания- Раствор, концентрация которого точно известна, называется стандартным раствором .
- Стандартный раствор можно приготовить методом взвешивания следующим образом.
(a) Рассчитывается и взвешивается необходимая масса растворенного вещества.
(b) Растворенное вещество растворяют в небольшом количестве дистиллированной воды в химическом стакане.
(c) Раствор переносят в мерную колбу.
(d) Добавляют больше дистиллированной воды, чтобы получить требуемый объем. Колбу закрывают пробкой и встряхивают.
Колбу закрывают пробкой и встряхивают. - Например, для приготовления 1,0 дм 3 0,50 моль дм -3 водного едкого натра.
- Очень точный стандартный щелочной раствор не может быть приготовлен с использованием гидроксида натрия в качестве основного стандарта. Это связано с тем, что
(а) гидроксид натрия расплывается. Он впитывает влагу и растворяется, образуя раствор.
(b) гидроксид натрия может быть нечистым. Реагирует с углекислым газом из воздуха:
2NaOH(т) + CO 2 (г) → Na 2 CO 3 (т) + H 2 O(ж)
Следовательно, концентрация этого щелочного раствора неточна. - Чистый безводный карбонат натрия, Na 2 CO 3 , используется для приготовления первичного стандартного щелочного раствора.
- Твердые органические кислоты, такие как щавелевая кислота, H 2 C 2 O 4 .2H 2 O, используется для приготовления первичного стандартного кислого раствора.

- Стандартный раствор также можно приготовить методом разбавления.
Люди также спрашивают
- Что такое определение кислоты и основания?
- Какое определение кислоты в химии?
- Каково определение основания в химии?
- Классификация кислот
- Получение кислот
- Каковы химические свойства кислоты?
- Общие свойства кислот
- Использование кислот
- Получение оснований
- Общие свойства оснований
- Что определяет сильное основание и слабое основание
- Для чего используются основания
- Как мы можем измерить силу кислот и щелочей?
- Как рассчитать концентрацию кислот и щелочей?
- Что понимается под реакцией нейтрализации?
- Как титрование определяет концентрацию?
- Связь между значениями рН и молярностью кислот и щелочей
- Концепция шкалы рН
- Роль рН в повседневной жизни
- Каков рН раствора соли
- Стандартный раствор также можно приготовить путем разбавления .
 Стандартные кислоты, такие как соляная кислота, серная кислота и азотная кислота, получают путем разбавления коммерческих концентрированных кислот (исходных растворов) различным количеством дистиллированной воды.
Стандартные кислоты, такие как соляная кислота, серная кислота и азотная кислота, получают путем разбавления коммерческих концентрированных кислот (исходных растворов) различным количеством дистиллированной воды. - Добавление воды к концентрированному раствору:
(а) изменение концентрации раствора
(b) не изменяет количество молей присутствующего растворенного вещества - Это означает, что общее количество молей частиц растворенного вещества до разбавления равно общему количеству молей частиц растворенного вещества после проведения разбавления.
Моль растворенного вещества до разбавления = моли растворенного вещества после разбавления - Уравнение разбавления может быть получено, как показано ниже.
Поскольку добавление воды не меняет количество молей частиц растворенного вещества,
M 1 V 1 = M 2 V 2
На рисунке показано, как Пример выполняется в лаборатории.
- Необходимо точно отмерить требуемый объем исходного раствора. Используйте пипетку , чтобы точно отмерить 25,0 см 3 маточного раствора. Используйте бюретку для измерения других объемов менее 50,0 см 3 .
- Например, для подготовки 500 см 3 0,15 моль дм -3 серная кислота из маточного раствора 2,0 моль дм -3 серная кислота.
(a) Рассчитайте необходимый объем маточного раствора.
(b) Наполните бюретку маточным раствором.
Вылейте 37,5 см 3 исходного раствора в мерную колбу объемом 500 см 3 , содержащую некоторое количество дистиллированной воды.
(c) Добавьте в колбу еще дистиллированной воды, постоянно взбалтывая. Затем с помощью пипетки добавьте дистиллированную воду, чтобы довести мениск до калибровочной отметки. Закройте колбу пробкой и хорошо встряхните, чтобы обеспечить тщательное перемешивание.



 Проведенные исследования не продемонстрировали значимых преимуществ одного раствора перед другим, но было показано, что реснички эпителия носовых проходов лучше сокращаются после гипертонического раствора. Также гипертонический раствор оказался чуть лучше в лечении синуситов (гайморита, фронтита).
Проведенные исследования не продемонстрировали значимых преимуществ одного раствора перед другим, но было показано, что реснички эпителия носовых проходов лучше сокращаются после гипертонического раствора. Также гипертонический раствор оказался чуть лучше в лечении синуситов (гайморита, фронтита).  Это сумма атомных (элементарных) масс
элемент(ы) компонента nd обычно можно найти на контейнере. Если
химическое вещество гидратировано, то есть имеет молекулы воды, связанные с
Это необходимо учитывать при расчете требуемой массы.
Это сумма атомных (элементарных) масс
элемент(ы) компонента nd обычно можно найти на контейнере. Если
химическое вещество гидратировано, то есть имеет молекулы воды, связанные с
Это необходимо учитывать при расчете требуемой массы.



 Однако вы можете взвесить известную массу до четырех
десятичные знаки точно. Отсюда можно точно рассчитать
концентрация химического вещества в растворе, так как вы будете знать массу
и объема с высокой степенью точности.
Однако вы можете взвесить известную массу до четырех
десятичные знаки точно. Отсюда можно точно рассчитать
концентрация химического вещества в растворе, так как вы будете знать массу
и объема с высокой степенью точности.
 (NH 4 ) 2 FeSO 4 .6H 2 0.
(NH 4 ) 2 FeSO 4 .6H 2 0. 6H 2 0,
6H 2 0, затем
отставьте стакан в сторону и поднимите воронку из колбы, пока
промыв его дистиллированной водой. Теперь вы достигли количественного переноса . Встряхните жидкость в колбе, чтобы
предотвращения градиентов плотности.
затем
отставьте стакан в сторону и поднимите воронку из колбы, пока
промыв его дистиллированной водой. Теперь вы достигли количественного переноса . Встряхните жидкость в колбе, чтобы
предотвращения градиентов плотности. Поэтому вы должны точно знать массу
жидкость. Соединение можно дозировать методами при условии, что пипетка, шприц и т. д. точны, и, таким образом, масса =
объем х плотность с учетом температурного фактора.
Поэтому вы должны точно знать массу
жидкость. Соединение можно дозировать методами при условии, что пипетка, шприц и т. д. точны, и, таким образом, масса =
объем х плотность с учетом температурного фактора. Колбу закрывают пробкой и встряхивают.
Колбу закрывают пробкой и встряхивают.
 Стандартные кислоты, такие как соляная кислота, серная кислота и азотная кислота, получают путем разбавления коммерческих концентрированных кислот (исходных растворов) различным количеством дистиллированной воды.
Стандартные кислоты, такие как соляная кислота, серная кислота и азотная кислота, получают путем разбавления коммерческих концентрированных кислот (исходных растворов) различным количеством дистиллированной воды.